Carbonsäuren: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) (→Eigenschaften) |
Dg (Diskussion | Beiträge) |
||
| (34 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
{{navi|Säure-Base-Reaktionen|Carboxylgruppe}} | {{navi|Säure-Base-Reaktionen|Carboxylgruppe}} | ||
| + | |||
== Was sind Carbonsäuren? == | == Was sind Carbonsäuren? == | ||
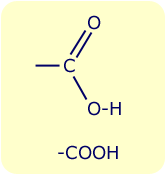
[[Bild:COOH.gif|right|Carboxylgruppe]] | [[Bild:COOH.gif|right|Carboxylgruppe]] | ||
| − | Carbonsäuren sind organische Säuren bestehend aus einer [[Kohlenwasserstoff]]kette mit der [[funktionelle Gruppe|funktionellen Gruppe]] [[Carboxylgruppe|-COOH]] ([[Carboxylgruppe]]). Sie kommen sowohl als freie Säure als auch in ver[[ester]]ter Form in der Natur vor (z.B. Schweiß, Tiersekrete, Pflanzensäfte) | + | Carbonsäuren sind organische Säuren bestehend aus einer [[Kohlenwasserstoff]]kette mit der [[funktionelle Gruppe|funktionellen Gruppe]] [[Carboxylgruppe|-COOH]] ([[Carboxylgruppe]]). Sie kommen sowohl als freie Säure als auch in ver[[ester]]ter Form in der Natur vor (z. B. Schweiß, Tiersekrete, Pflanzensäfte). |
=== Einteilung === | === Einteilung === | ||
Carbonsäuren sind unterteilt in: | Carbonsäuren sind unterteilt in: | ||
| − | *Alkansäuren | + | * gesättigte Carbonsäuren: Alkansäuren, also nur Einfachbindungen im Rest |
| − | *[[Fettsäuren]] ( | + | * ungesättigte Carbonsäuren (Alkensäuren) mit mindestens einer [[Doppelbindung]] im Rest |
| + | * [[Fettsäuren]] sind langkettige Carbonsäuren (mehr als 4 C-Atomen) und können gesättigt oder ungesättigt sein | ||
| + | * nach Anzahl der Carboxylgruppen unterscheidet man in Monocarbonsäuren, Di-C. usw. | ||
=== Verwendung === | === Verwendung === | ||
| Zeile 16: | Zeile 19: | ||
*stark riechend | *stark riechend | ||
*flüssig oder fest | *flüssig oder fest | ||
| − | *polar (bei kurzer C-Kette polar bei langer unpolar) | + | *[[polar]] (bei kurzer C-Kette polar bei langer unpolar) |
*hoher [[Siedepunkt]] (mit zunehmender Kettenlänge steigen die [[Van-der-Waals-Kräfte]] -> hoher [[Siedepunkt]]) | *hoher [[Siedepunkt]] (mit zunehmender Kettenlänge steigen die [[Van-der-Waals-Kräfte]] -> hoher [[Siedepunkt]]) | ||
*hoher [[Schmelzpunkt]] | *hoher [[Schmelzpunkt]] | ||
| Zeile 29: | Zeile 32: | ||
*Dies ist auf den negativen induktiven Effekt des Carbonyl-O-Atoms zurückzuführen ([[Carbonylgruppe]] >C=O) Die [[Elektron]]en werden dem H-Atom entzogen Richtung O-Atom, dadurch kann es als H<sup>+</sup> leichter abgespalten werden. | *Dies ist auf den negativen induktiven Effekt des Carbonyl-O-Atoms zurückzuführen ([[Carbonylgruppe]] >C=O) Die [[Elektron]]en werden dem H-Atom entzogen Richtung O-Atom, dadurch kann es als H<sup>+</sup> leichter abgespalten werden. | ||
| − | :Die [[Acidität]] nimmt mit zunehmender Länge des [[Alkylrest]]s ab. Der nun zunehmende positive induktive Effekt des Alkylrests (R) vermindert die Polarität der OH-Bindung. Das H kann nicht so leicht abgespalten werden. | + | :Die [[Acidität]] nimmt mit zunehmender Länge des [[Alkylrest]]s ab. Der nun zunehmende positive induktive Effekt des Alkylrests (R) vermindert die [[Polarität]] der OH-Bindung. Das H kann nicht so leicht abgespalten werden. |
*Allerdings können Substituenten im Alkylrest (Atome bzw Atomgruppen) auch die [[Acidität]] erhöhen (je nach Stärke des positiven induktiven Effekt). | *Allerdings können Substituenten im Alkylrest (Atome bzw Atomgruppen) auch die [[Acidität]] erhöhen (je nach Stärke des positiven induktiven Effekt). | ||
http://www.oci.uzh.ch/group.pages/robinson/lectures/AC_BII/Kap11/11.3.1.gif | http://www.oci.uzh.ch/group.pages/robinson/lectures/AC_BII/Kap11/11.3.1.gif | ||
Quelle: http://www.oci.uzh.ch | Quelle: http://www.oci.uzh.ch | ||
| − | == | + | == Auswahl bedeutsamer Carbonsäuren == |
| − | |||
=== [[Ameisensäure]] === | === [[Ameisensäure]] === | ||
| − | + | === [[Ascorbinsäure]] === | |
| + | === [[Buttersäure]] === | ||
| + | === [[Citronensäure]] === | ||
=== [[Essigsäure]] === | === [[Essigsäure]] === | ||
| + | === [[Milchsäure]] === | ||
| + | === [[Oxalsäure]] === | ||
| + | === [[Propionsäure]] === | ||
| + | === [[Sorbinsäure]] === | ||
| − | == | + | == Experimente == |
| − | + | {{chas|15-11|Acidität von Carbonsäuren - Reaktion mit Magnesium}} | |
| − | === | + | {{chas|15-12|Acidität von Carbonsäuren - pH-Wert-Messung}} |
| − | + | {{Ex-ch09|{{fb|322}}|2|Redoxreaktionen von Carbonyl-Verbindungen|Ameisensäure und Essigsäure im Vergleich}} | |
| − | 2- | + | {{Ex-ch09|{{fb|322}}|3|Redoxreaktionen von Carbonyl-Verbindungen|Synthese von Essigsäure}} |
| − | + | === Carbonsäuren in Lebensmitteln === | |
| − | + | * [[Säuregrad|Bestimmung des Säuregrades von Milch]] | |
| − | + | {{Ex-ch|123|5|Bestimmung der Säure-Konzentration in Nahrungsmitteln}} | |
| − | + | {{Ex-ch|276|2|Bestimmung des [[Säurestärke#pKS-Werte|p''K''<sub>S</sub>-Wertes]] von Sorbinsäure}} | |
| − | + | {{Ex-ec|116|1-3|Organische Säuren in Lebensmitteln}} | |
| − | + | {{Ex-ec|222|1, 3|Säuren und Basen in Produkten des Alltags}} | |
| − | |||
| − | |||
| − | === | + | === Aromastoffe aus Carbonsäuren === |
| + | {{Ex-ch|274|1|Aromastoffe}} | ||
=== Herstellung von Brausepulver === | === Herstellung von Brausepulver === | ||
| Zeile 78: | Zeile 85: | ||
[[Natriumhydrogencarbonat|NaHCO<sub>3</sub>]] + [[Citronensäure|C<sub>6</sub>H<sub>8</sub>O<sub>7</sub>]] [[Bild:Pfeil.gif]] COONa + [[Wasser|H<sub>2</sub>O]] + [[Kohlenstoffdioxid|CO<sub>2</sub>]] + C<sub>5</sub>H<sub>7</sub>O<sub>5</sub> | [[Natriumhydrogencarbonat|NaHCO<sub>3</sub>]] + [[Citronensäure|C<sub>6</sub>H<sub>8</sub>O<sub>7</sub>]] [[Bild:Pfeil.gif]] COONa + [[Wasser|H<sub>2</sub>O]] + [[Kohlenstoffdioxid|CO<sub>2</sub>]] + C<sub>5</sub>H<sub>7</sub>O<sub>5</sub> | ||
| + | {{cb|-|266 u. 418|113}} | ||
| + | == Übungsaufgaben == | ||
| + | {{Ue-ec|124|A9|funktionelle Gruppen in Milchsäure}} | ||
| + | {{K|11|15}} | ||
| + | {{Z|unterscheiden|[[Stoffgruppe|Stoffklassen]] der [[Alkane]], [[Alkene]], [[Alkanole]], [[Alkanale]], [[Ketone|Alkanon]]e und [[Alkansäure]]n anhand ihrer Molekülstruktur und ihrer [[funktionelle Gruppe|funktionellen Gruppen]]|15}} | ||
{{www}} | {{www}} | ||
| − | {{ | + | {{cona|Chemie_Carbonsaeure.pdf}} |
| − | |||
{{Chemikalien}} | {{Chemikalien}} | ||
[[Kategorie:Chemie]][[Kategorie:Chemikalien]] | [[Kategorie:Chemie]][[Kategorie:Chemikalien]] | ||
[[Kategorie:Ernährungslehre]] | [[Kategorie:Ernährungslehre]] | ||
Aktuelle Version vom 25. Dezember 2017, 23:47 Uhr
| Carbonsäuren | ||
|---|---|---|
| vernetzte Artikel | ||
| Säure-Base-Reaktionen | Carboxylgruppe | |
Inhaltsverzeichnis
Was sind Carbonsäuren?
Carbonsäuren sind organische Säuren bestehend aus einer Kohlenwasserstoffkette mit der funktionellen Gruppe -COOH (Carboxylgruppe). Sie kommen sowohl als freie Säure als auch in veresterter Form in der Natur vor (z. B. Schweiß, Tiersekrete, Pflanzensäfte).
Einteilung
Carbonsäuren sind unterteilt in:
- gesättigte Carbonsäuren: Alkansäuren, also nur Einfachbindungen im Rest
- ungesättigte Carbonsäuren (Alkensäuren) mit mindestens einer Doppelbindung im Rest
- Fettsäuren sind langkettige Carbonsäuren (mehr als 4 C-Atomen) und können gesättigt oder ungesättigt sein
- nach Anzahl der Carboxylgruppen unterscheidet man in Monocarbonsäuren, Di-C. usw.
Verwendung
Die Verwendung der Carbonsäuren und ihrer Salze ist äußerst vielseitig. Sie dienen als Lebensmittel-Zusatzstoffe und stellen wichtige Zwischenprodukte für zahlreiche andere Stoffe und Stoffgruppen der organischen Chemie dar, z.B. zur Herstellung von Riechstoffen oder von Kunststoffen, Seifen, Tensiden, Harzen, Medikamenten und Farbstoffen.
Eigenschaften
- farblos
- stark riechend
- flüssig oder fest
- polar (bei kurzer C-Kette polar bei langer unpolar)
- hoher Siedepunkt (mit zunehmender Kettenlänge steigen die Van-der-Waals-Kräfte -> hoher Siedepunkt)
- hoher Schmelzpunkt
- leiten Strom (nur wenn sie mit Wasser verdünnt sind und Ionen bilden)
- brennbar
- reagieren mit Laugen zu Wasser + Salz
- reagieren mit Alkohol zu Wasser + Ester
Acidität
- Carbonsäuren reagieren in wässrigen Lösungen sauer. Die korrespondierende Base ist das Carboxylat-Anion (COO-)
- Dies ist auf den negativen induktiven Effekt des Carbonyl-O-Atoms zurückzuführen (Carbonylgruppe >C=O) Die Elektronen werden dem H-Atom entzogen Richtung O-Atom, dadurch kann es als H+ leichter abgespalten werden.
- Die Acidität nimmt mit zunehmender Länge des Alkylrests ab. Der nun zunehmende positive induktive Effekt des Alkylrests (R) vermindert die Polarität der OH-Bindung. Das H kann nicht so leicht abgespalten werden.
- Allerdings können Substituenten im Alkylrest (Atome bzw Atomgruppen) auch die Acidität erhöhen (je nach Stärke des positiven induktiven Effekt).
 Quelle: http://www.oci.uzh.ch
Quelle: http://www.oci.uzh.ch
Auswahl bedeutsamer Carbonsäuren
Ameisensäure
Ascorbinsäure
Buttersäure
Citronensäure
Essigsäure
Milchsäure
Oxalsäure
Propionsäure
Sorbinsäure
Experimente
- Acidität von Carbonsäuren - Reaktion mit Magnesium, in: Chemie? - Aber sicher!, Seite 15-11
- Acidität von Carbonsäuren - pH-Wert-Messung, in: Chemie? - Aber sicher!, Seite 15-12
- Redoxreaktionen von Carbonyl-Verbindungen: Ameisensäure und Essigsäure im Vergleich, in: Chemie heute SII, Seite 322, Versuch 2
- Redoxreaktionen von Carbonyl-Verbindungen: Synthese von Essigsäure, in: Chemie heute SII, Seite 322, Versuch 3
Carbonsäuren in Lebensmitteln
- Bestimmung des Säuregrades von Milch
- Bestimmung der Säure-Konzentration in Nahrungsmitteln, in: Chemie heute (Ausgabe 1998), Seite 123, Versuch 5
- Bestimmung des pKS-Wertes von Sorbinsäure, in: Chemie heute (Ausgabe 1998), Seite 276, Versuch 2
- Organische Säuren in Lebensmitteln, in: Elemente Chemie 2, Seite 116, Versuch 1-3
- Säuren und Basen in Produkten des Alltags, in: Elemente Chemie 2, Seite 222, Versuch 1, 3
Aromastoffe aus Carbonsäuren
- Aromastoffe, in: Chemie heute (Ausgabe 1998), Seite 274, Versuch 1
Herstellung von Brausepulver
Material:
- 1 Becherglas
- Teelöffel
Chemikalien bzw. Lebensmittel:
- Natronpulver (Natriumhydrogencarbonat)3 Löffelenden
- Citronensäure 1 kleinen Teelöffel
- Götterspeise für den Geschmack 1 großen Teelöffel
- Zucker 1 Teelöffel
Durchführung:
Alle Zutaten in das Becherglas geben und gut verrühren.
Folgende Reaktion findet statt:
NaHCO3 + C6H8O7 ![]() COONa + H2O + CO2 + C5H7O5
COONa + H2O + CO2 + C5H7O5
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Carbonsäuren: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Übungsaufgaben
- Elemente Chemie 2, Seite 124, Aufgabe A9: funktionelle Gruppen in Milchsäure
Carbonsäuren als Unterrichtsthema in Klasse 11
- Stoffklassen der Alkane, Alkene, Alkanole, Alkanale, Alkanone und Alkansäuren anhand ihrer Molekülstruktur und ihrer funktionellen Gruppen unterscheiden können.[1]
Weblinks
- Carbonsäuren als Google-Suchbegriff
- Carbonsäuren in der Wikipedia
- Carbonsäuren hier in bs-wiki.de mit Google
- Carbonsäuren als Youtube-Video
- Versuchsanleitungen der Fa. Conatex zum Thema Carbonsäuren als PDF-Datei zum Download
| |
Auf Chemikalien-Gefäßen finden sich codierte Hinweise auf Gefährdungen und entsprechende Vorsorgemaßnahmen beim Umgang mit dieser Chemikalie. Diese sogenannten H- & P-Sätze hängen gemeinsam mit den Arbeitsregeln für Schülerexperimente als Betriebsanweisung im Chemieraum aus und müssen in jedem Fall beachtet werden! |
- ↑ Niedersächsisches Kultusministerium (Herausgeber): Kerncurriculum Chemie für das Gymnasium – gymnasiale Oberstufe, Hannover 2017, Seite 15.