Ester: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| (16 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
{{navi|Kondensationsreaktion|Stoffgruppe}} | {{navi|Kondensationsreaktion|Stoffgruppe}} | ||
== Was sind Ester? == | == Was sind Ester? == | ||
| − | Als {{PAGENAME}} bezeichnet man die [[Stoffgruppe]] mit der [[funktionelle Gruppe|funktionellen]] COOR-Gruppe (R= Kohlenwasserstoffrest). | + | Als {{PAGENAME}} bezeichnet man die [[Stoffgruppe]] mit der [[funktionelle Gruppe|funktionellen]] COOR-Gruppe (Carbonsäureestergruppe, Alkoxycarbonylgruppe, R = Kohlenwasserstoffrest). |
Beispiel: [[Essigsäureethylester]] http://upload.wikimedia.org/wikipedia/commons/thumb/4/4d/Essigs%C3%A4ureethylester.svg/200px-Essigs%C3%A4ureethylester.svg.png | Beispiel: [[Essigsäureethylester]] http://upload.wikimedia.org/wikipedia/commons/thumb/4/4d/Essigs%C3%A4ureethylester.svg/200px-Essigs%C3%A4ureethylester.svg.png | ||
=== Veresterung === | === Veresterung === | ||
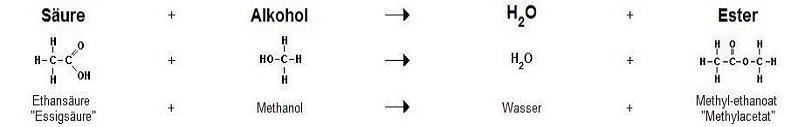
| − | Ester entstehen bei der Reaktion von [[Alkohol]]en mit [[Carbonsäuren]] oder anorganischen [[Säuren]] bei gleichzeitiger Abspaltung von Wasser ([[Kondensationsreaktion]], hier: [[Dehydratisierung]]). | + | Ester entstehen bei der Reaktion von [[Alkohol]]en mit [[Carbonsäuren]] oder anorganischen [[Säuren]] bei gleichzeitiger Abspaltung von Wasser ([[Kondensationsreaktion]], hier: [[Dehydratisierung]]). |
[[Bild:Ester.jpg|Die Entstehung von Estern]] | [[Bild:Ester.jpg|Die Entstehung von Estern]] | ||
=== Esterspaltung === | === Esterspaltung === | ||
Die Umkehrung (= Rückreaktion) der Veresterung ist die Esterspaltung (= Esterhydrolyse). Da beide Reaktionen gleichzeitig ablaufen, spricht man von einer [[Gleichgewichtsreaktion]]. | Die Umkehrung (= Rückreaktion) der Veresterung ist die Esterspaltung (= Esterhydrolyse). Da beide Reaktionen gleichzeitig ablaufen, spricht man von einer [[Gleichgewichtsreaktion]]. | ||
| − | + | === Eigenschaften === | |
| + | * '''schlecht wasserlöslich bis hydrophop:''' Carbonsäureester sind im Bereich der beiden Sauerstoffatome schwach [[Polarität|polarisiert]]. Je länger die unpolaren Kohlenwasserstoffketten werden, desto geringer ist die Wasserlöslichkeit des Estermoleküls. '''Zum Vergleich:''' In 1 l Wasser lösen sich 250 g Essigsäuremethylester aber nur noch 80 g Essigsäureethylester. Alle längerkettigen Ester sind also hydrophob. | ||
| + | * '''Schmelz- u. Siedepunkte''' liegen im Vergleich zu [[Alkohole]]n bzw. [[Carbonsäuren]] gleicher Kettenlänge durch nur geringe Ausbildung von [[Wasserstoffbrücken-Bindung]]en wesentlich niedriger. | ||
== Beispiele == | == Beispiele == | ||
* Die [[Ester]] der niederen Fettsäuren (1-7 Kohlenstoffatome) nutzt man auch in der [[Parfüm]]- und Duftherstellung. Z. B. zeichnen sich die Ester der übelriechenden [[Carbons%C3%A4uren#Butters.C3.A4ure| Buttersäure]] durch fruchtartigen Geruch aus. | * Die [[Ester]] der niederen Fettsäuren (1-7 Kohlenstoffatome) nutzt man auch in der [[Parfüm]]- und Duftherstellung. Z. B. zeichnen sich die Ester der übelriechenden [[Carbons%C3%A4uren#Butters.C3.A4ure| Buttersäure]] durch fruchtartigen Geruch aus. | ||
* [[Fett]]e | * [[Fett]]e | ||
* [[Sekundenkleber]] | * [[Sekundenkleber]] | ||
| + | |||
| + | == Übungsaufgaben == | ||
| + | {{Ue-ec|118|A1|Ester}} | ||
| + | {{Ue-ec|121|A1|Ester}} | ||
| + | {{Ue-ec|124|A8|Essigsäure und 2-Methylpropan-1-ol}} | ||
| + | {{Ue-ec|124|A11|Esterspaltung}} | ||
| + | # Vervollständige: Fruchtester lassen sich synthetisch durch die Reaktion einer Carbonsäure mit einem ________________ herstellen. Da die ________________________ der Veresterung sehr klein ist, wird diese im Allgemeinen durch Zugabe eines _______________________ erhöht, z. B. _______________________ . Die funktionelle Gruppe der Ester ist die ________________-Gruppe. | ||
| + | # a) Zeichne die Strukturformel für eine Komponente des Birnenaromas, den Ethansäurepentylester. b) Formuliere die Reaktionsgleichung (mit Strukturformeln und Stoffbezeichnungen) zur Herstellung dieses Fruchtesters. | ||
| + | # Baue mit dem Molekülbaukasten in Partnerarbeit folgende Ester aus den entsprechenden Säuren und Alkanolen und formuliere die dazugehörigen Reaktionsgleichungen: | ||
| + | :: - Methansäureethylester | ||
| + | :: - Butansäurepropylester | ||
| + | :: - Pentansäuremethylester | ||
== Experimente == | == Experimente == | ||
{{Ex-ch|274|1|Aromastoffe}} | {{Ex-ch|274|1|Aromastoffe}} | ||
* [[Essigsäureethylester]] | * [[Essigsäureethylester]] | ||
| − | {{Ex-ch|96|3|{{ | + | {{Ex-ch|96|3|Estergleichgewicht}} |
| + | {{Ex-ch09|{{fb|330}}|1|Estergleichgewicht|Essigsäureethylester-Gleichgewicht}} | ||
| + | {{Ex-ch09|{{fb|108}}|2|Untersuchung von Gleichgewichten|Gleichgewichtseinstellung bei der Veresterung}} | ||
{{Ex-ec|118|1-5|Veresterung und Esterspaltung}} | {{Ex-ec|118|1-5|Veresterung und Esterspaltung}} | ||
{{Ex-ec|144|1|Veresterung und Esterspaltung}} | {{Ex-ec|144|1|Veresterung und Esterspaltung}} | ||
{{Ex-ec|146|1|Veresterung und Esterspaltung}} | {{Ex-ec|146|1|Veresterung und Esterspaltung}} | ||
| + | {{CK|277|Borsäureester}} | ||
| + | {{CK|282|Ester als natürliche Duftstoffe}} | ||
{{www}} | {{www}} | ||
{{cb|-|270|118}} | {{cb|-|270|118}} | ||
| − | + | {{cona|Chemie_Ester.pdf}} „Chemie riecht gut.“ | |
* [http://www.seilnacht{{c}}Download/Abester.doc Thomas Seilnacht: Die Herstellung von Aromastoffen] | * [http://www.seilnacht{{c}}Download/Abester.doc Thomas Seilnacht: Die Herstellung von Aromastoffen] | ||
* zwei Varianten zur Herstellung von Essigsäurepentylester (Birnengeruch) aus [[Pentanol|1-Pentanol]] und Essigsäure mittels:<br />[http://www.educ.ethz.ch/unt/um/che/boc/fruchtester/index - Schwefelsäure (Urs Wuthier, ETH Zürich)]<br />[http://www.chids.de/dachs/praktikumsprotokolle/PP0212Veresterung.pdf - wasserfreies [[Zinkchlorid]] (Christian Lego, Uni Marburg)] | * zwei Varianten zur Herstellung von Essigsäurepentylester (Birnengeruch) aus [[Pentanol|1-Pentanol]] und Essigsäure mittels:<br />[http://www.educ.ethz.ch/unt/um/che/boc/fruchtester/index - Schwefelsäure (Urs Wuthier, ETH Zürich)]<br />[http://www.chids.de/dachs/praktikumsprotokolle/PP0212Veresterung.pdf - wasserfreies [[Zinkchlorid]] (Christian Lego, Uni Marburg)] | ||
| + | * Dr. Horst Klemeyer: Die Ester aus primären n-Alkanolen mit n-Carbonsäuren im Überblick, in: [http://www.lv-niedersachsen.mnu.de/images/2014G%C3%B6ttingen/Gefbu-Beispiele_maunuel.pdf Beispiele und Übungen zur Erstellung von Gefährdungsbeurteilungen, S. 24ff] | ||
[[Kategorie:Chemie]][[Kategorie:Chemikalien]] | [[Kategorie:Chemie]][[Kategorie:Chemikalien]] | ||
Aktuelle Version vom 10. Januar 2017, 21:03 Uhr
Inhaltsverzeichnis
Was sind Ester?
Als Ester bezeichnet man die Stoffgruppe mit der funktionellen COOR-Gruppe (Carbonsäureestergruppe, Alkoxycarbonylgruppe, R = Kohlenwasserstoffrest).
Beispiel: Essigsäureethylester 
Veresterung
Ester entstehen bei der Reaktion von Alkoholen mit Carbonsäuren oder anorganischen Säuren bei gleichzeitiger Abspaltung von Wasser (Kondensationsreaktion, hier: Dehydratisierung).
Esterspaltung
Die Umkehrung (= Rückreaktion) der Veresterung ist die Esterspaltung (= Esterhydrolyse). Da beide Reaktionen gleichzeitig ablaufen, spricht man von einer Gleichgewichtsreaktion.
Eigenschaften
- schlecht wasserlöslich bis hydrophop: Carbonsäureester sind im Bereich der beiden Sauerstoffatome schwach polarisiert. Je länger die unpolaren Kohlenwasserstoffketten werden, desto geringer ist die Wasserlöslichkeit des Estermoleküls. Zum Vergleich: In 1 l Wasser lösen sich 250 g Essigsäuremethylester aber nur noch 80 g Essigsäureethylester. Alle längerkettigen Ester sind also hydrophob.
- Schmelz- u. Siedepunkte liegen im Vergleich zu Alkoholen bzw. Carbonsäuren gleicher Kettenlänge durch nur geringe Ausbildung von Wasserstoffbrücken-Bindungen wesentlich niedriger.
Beispiele
- Die Ester der niederen Fettsäuren (1-7 Kohlenstoffatome) nutzt man auch in der Parfüm- und Duftherstellung. Z. B. zeichnen sich die Ester der übelriechenden Buttersäure durch fruchtartigen Geruch aus.
- Fette
- Sekundenkleber
Übungsaufgaben
- Elemente Chemie 2, Seite 118, Aufgabe A1: Ester
- Elemente Chemie 2, Seite 121, Aufgabe A1: Ester
- Elemente Chemie 2, Seite 124, Aufgabe A8: Essigsäure und 2-Methylpropan-1-ol
- Elemente Chemie 2, Seite 124, Aufgabe A11: Esterspaltung
- Vervollständige: Fruchtester lassen sich synthetisch durch die Reaktion einer Carbonsäure mit einem ________________ herstellen. Da die ________________________ der Veresterung sehr klein ist, wird diese im Allgemeinen durch Zugabe eines _______________________ erhöht, z. B. _______________________ . Die funktionelle Gruppe der Ester ist die ________________-Gruppe.
- a) Zeichne die Strukturformel für eine Komponente des Birnenaromas, den Ethansäurepentylester. b) Formuliere die Reaktionsgleichung (mit Strukturformeln und Stoffbezeichnungen) zur Herstellung dieses Fruchtesters.
- Baue mit dem Molekülbaukasten in Partnerarbeit folgende Ester aus den entsprechenden Säuren und Alkanolen und formuliere die dazugehörigen Reaktionsgleichungen:
- - Methansäureethylester
- - Butansäurepropylester
- - Pentansäuremethylester
Experimente
- Aromastoffe, in: Chemie heute (Ausgabe 1998), Seite 274, Versuch 1
- Essigsäureethylester
- Estergleichgewicht, in: Chemie heute (Ausgabe 1998), Seite 96, Versuch 3
- Estergleichgewicht: Essigsäureethylester-Gleichgewicht, in: Chemie heute SII, Seite 330, Versuch 1
- Untersuchung von Gleichgewichten: Gleichgewichtseinstellung bei der Veresterung, in: Chemie heute SII, Seite 108, Versuch 2
- Veresterung und Esterspaltung, in: Elemente Chemie 2, Seite 118, Versuch 1-5
- Veresterung und Esterspaltung, in: Elemente Chemie 2, Seite 144, Versuch 1
- Veresterung und Esterspaltung, in: Elemente Chemie 2, Seite 146, Versuch 1
- Borsäureester, in: Chemische Kabinettstücke, S. 277.
- Ester als natürliche Duftstoffe, in: Chemische Kabinettstücke, S. 282.
Weblinks
- Ester als Google-Suchbegriff
- Ester in der Wikipedia
- Ester hier in bs-wiki.de mit Google
- Ester als Youtube-Video
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Ester: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
- Versuchsanleitungen der Fa. Conatex zum Thema Ester als PDF-Datei zum Download „Chemie riecht gut.“
- Thomas Seilnacht: Die Herstellung von Aromastoffen
- zwei Varianten zur Herstellung von Essigsäurepentylester (Birnengeruch) aus 1-Pentanol und Essigsäure mittels:
- Schwefelsäure (Urs Wuthier, ETH Zürich)
- wasserfreies Zinkchlorid (Christian Lego, Uni Marburg) - Dr. Horst Klemeyer: Die Ester aus primären n-Alkanolen mit n-Carbonsäuren im Überblick, in: Beispiele und Übungen zur Erstellung von Gefährdungsbeurteilungen, S. 24ff