Carbonylgruppe: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) (→Quellen) |
Dg (Diskussion | Beiträge) |
||
| (34 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| + | {{navi|Aldehyde|Ketone}} | ||
== Definition == | == Definition == | ||
[[Bild:Carbonyl.gif|right]] | [[Bild:Carbonyl.gif|right]] | ||
| − | Carbonylgruppen sind [[funktionelle Gruppe]]n in organischen Verbindungen. Sie bestehen aus einem [[Kohlenstoff]]- und einem [[Sauerstoff]]atom, die durch eine C=O Doppelbindung verknüpft sind. | + | Carbonylgruppen sind [[funktionelle Gruppe]]n in organischen Verbindungen. Sie bestehen aus einem [[Kohlenstoff]]- und einem [[Sauerstoff]]atom, die durch eine C=O-Doppelbindung verknüpft sind. |
=== Die wichtigsten Carbonylgruppen === | === Die wichtigsten Carbonylgruppen === | ||
| Zeile 20: | Zeile 21: | ||
| [[Bild:Ester1.JPG]]|| | | [[Bild:Ester1.JPG]]|| | ||
|- | |- | ||
| − | ! Amid | + | ! [[Amid]] |
| [[Bild:Amid1.JPG]]|| | | [[Bild:Amid1.JPG]]|| | ||
|} | |} | ||
| Zeile 27: | Zeile 28: | ||
'''Man kann diese Carbonylverbindungen in zwei Untergruppen einteilen:''' | '''Man kann diese Carbonylverbindungen in zwei Untergruppen einteilen:''' | ||
| − | ''1. Aldehyde und Ketone'' | + | ''1. [[Aldehyde]] und [[Ketone]]'' |
| − | Aldehyde und Ketone können keine negative Ladung tragen, denn sie besitzen weder ein H-Atom noch eine Alkyl- oder Aryl-Gruppe. Aus diesem Grund können sie auch nicht als Abgabgsgruppe dienen. | + | [[Aldehyde]] und [[Ketone]] können keine negative Ladung tragen, denn sie besitzen weder ein H-Atom noch eine Alkyl- oder Aryl-Gruppe. Aus diesem Grund können sie auch nicht als Abgabgsgruppe dienen. |
| − | Aldehyde und Ketone verfügen über ähnliche chemische Eigenschaften wie Carbonsäurederivate, unterscheiden sich aber dennoch von ihnen. | + | |
| + | [[Aldehyde]] und [[Ketone]] verfügen über ähnliche chemische Eigenschaften wie Carbonsäurederivate, unterscheiden sich aber dennoch von ihnen. | ||
''2. Acyl-Rest (RCO) in Carbonsäuren und ihre Derivate'' | ''2. Acyl-Rest (RCO) in Carbonsäuren und ihre Derivate'' | ||
| − | Acyl-Rest (RCO) in Carbonsäuren und ihre Derivate sind elektronegative Heteroatome, sie tragen also eine negative Ladung und können aus diesem Grund als Abgangsgruppe dienen. | + | Acyl-Rest (RCO) in [[Carbonsäuren]] und ihre Derivate sind [[EN|elektronegative]] Heteroatome, sie tragen also eine negative Ladung und können aus diesem Grund als Abgangsgruppe dienen. |
Die Chemie dieser Carbonylverbindungen ist deshalb untereinander ähnlich, weisen aber dennoch einige Unterschiede in ihren chemischen Eigenschaften auf. | Die Chemie dieser Carbonylverbindungen ist deshalb untereinander ähnlich, weisen aber dennoch einige Unterschiede in ihren chemischen Eigenschaften auf. | ||
== Carbonylverbindungen == | == Carbonylverbindungen == | ||
| − | + | [[Bild:Berries1.JPG|right]] | |
| − | [[Aldehyde]] und [[Ketone]] werden als Carbonylverbindungen bezeichnet, da sie beide die Carbonylgruppe als Strukturelement besitzen. Carbonylverbindungen mit einer endständigen Carbonyl-Gruppe werden als Aldehyde bezeichnet, | + | [[Aldehyde]] und [[Ketone]] werden als Carbonylverbindungen bezeichnet, da sie beide die Carbonylgruppe als Strukturelement besitzen. Carbonylverbindungen mit einer endständigen Carbonyl-Gruppe werden als [[Aldehyde]] bezeichnet. Verbindungen, bei denen die Carbonyl-Gruppe nicht endständig ist, heißen [[Ketone]]. |
| − | |||
Sie sind auch in der Natur zu finden, zum Beispiel spielen 28 verschiedene Carbonylverbindungen und deren Derivate eine große Rolle als Duftstoffe von Erdbeeren, Wein und auch Blumen. | Sie sind auch in der Natur zu finden, zum Beispiel spielen 28 verschiedene Carbonylverbindungen und deren Derivate eine große Rolle als Duftstoffe von Erdbeeren, Wein und auch Blumen. | ||
| − | |||
| − | |||
| − | |||
| − | |||
=== Formaldehyd und seine Verwendung === | === Formaldehyd und seine Verwendung === | ||
| − | + | [[Bild:Pfeil.gif]][[Formaldehyd]] | |
| − | [[Formaldehyd]] | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Additionsreaktionen == | == Additionsreaktionen == | ||
| − | + | Als ungesättigte Verbindungen sind [[Aldehyde]] und [[Ketone]] reaktionsfreudig. Es kommt zu sogenannten [[Additionsreaktion]]en, wobei die [[nucleophile Addition]] mit [[Oxonium]]-Ionen charakteristisch ist. Als Reaktionspartner dienen hierbei Alkohole, Wasser und [[Anion]]en. | |
| − | |||
| − | |||
'''Die Addition von Alkoholen an Carbonyl-Verbindungen läuft in zwei Schritten ab:''' | '''Die Addition von Alkoholen an Carbonyl-Verbindungen läuft in zwei Schritten ab:''' | ||
| Zeile 70: | Zeile 56: | ||
''1. Schritt:'' | ''1. Schritt:'' | ||
| − | Das Sauerstoff-Atom der Carbonylgruppe wird protoniert, d.h. ein Proton | + | Das Sauerstoff-Atom der Carbonylgruppe wird protoniert, d. h. ein Proton angelagert, wodurch es eine positive Ladung bekommt. Mit dem freien Elektronenpaar seines Sauerstoff-Atoms greift das [[nucleophil]]e Alkohol-[[Molekül]] nun das Carbonyl-C-Atom an. Durch Protonabgabe dieser Zwischenstufe wird so aus einem Aldehyd ein Halbacetal, aus einem Keton bildet sich auf diesem Weg ein Halbketal. Diese Moleküle besitzen die Eigenschaft, dass an ''einem'' ihrer C-Atome eine OH- sowie eine Ether-Gruppe sitzt. |
| + | ''2. Schritt:'' | ||
| − | + | In diesem Schritt wird zunächst die OH-Gruppe des Halbacetals/Halbketals protoniert und dann ein H<sub>2</sub>O-Molekül eliminiert. Folge: ein Acetal/Ketal entsteht. Ihre Bildung ist häufig durch ihren angenehmen Geruch erkennbar. | |
| − | + | [[Bild:Aluket.JPG|right]] | |
== Oxidation & Reduktion der Carbonyl-Gruppe == | == Oxidation & Reduktion der Carbonyl-Gruppe == | ||
| − | Die Carbonyl-Gruppe | + | Die [[Oxidationszahl#Oxidationszahlen_des_Kohlenstoffs|mittlere Oxidationszahl des Kohlenstoffs]] in der Carbonyl-Gruppe (in [[Aldehyde]]n: I, bei [[Ketone]]n II) lässt sowohl eine [[Oxidation]] (Erhöhung der Oxidationszahl) als auch eine [[Reduktion]] (Abnahme der Oxidationszahl) zu. Aldehyde lassen sich vergleichsweise gut oxidieren, bei [[Ketone]]n (Oxidationszahl II) funktioniert dies nur, wenn zuvor Bindungen gespalten wurden. [[Ketone]] wiederum lassen leichter reduzieren, da sie die [[Oxidationszahl]] II besitzenen. Auf diesem Wege kann gut experimentell zwischen [[Aldehyde]]n und [[Ketone]]n unterschieden werden (siehe Versuch). |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | ---- | ||
| + | <div style="text-align: right;">[O] = Oxidation<br />[H] = Reduktion<br />[[primärer Alkohol]], [[sekundärer Alkohol]], [[tertiärer Alkohol]], [[Carbonsäuren]] | ||
| + | </div> | ||
== Versuch == | == Versuch == | ||
| Zeile 104: | Zeile 88: | ||
*[[Fehlingsche Lösung]] I und II | *[[Fehlingsche Lösung]] I und II | ||
| − | * | + | *[[Propionaldehyd]] (1 ml) |
| − | *Glucose-Lösung | + | *[[Glucose]]-Lösung |
| − | *Aceton | + | *[[Aceton]] |
| Zeile 117: | Zeile 101: | ||
'''Durchführung:''' | '''Durchführung:''' | ||
| − | # Ein Gemisch aus je 5 ml FEHLING-Lösung I und II und 1 ml Propionaldehyd wird in einem [[Becherglas]] erhitzt. | + | # Ein Gemisch aus je 5 ml FEHLING-Lösung I und II und 1 ml [[Propionaldehyd]] wird in einem [[Becherglas]] erhitzt. |
# Der Versuchsaufbau wird noch einmal genau so nachgestellt, diesmal jedoch anstatt Propionaldehyd [[Glucose]]-Lösung verwenden. | # Der Versuchsaufbau wird noch einmal genau so nachgestellt, diesmal jedoch anstatt Propionaldehyd [[Glucose]]-Lösung verwenden. | ||
| Zeile 123: | Zeile 107: | ||
'''Zu beantworten:''' | '''Zu beantworten:''' | ||
| − | *Welche Beobachtungen | + | *Welche Beobachtungen machst Du? |
*Wie lässt sich die Reaktion erklären? | *Wie lässt sich die Reaktion erklären? | ||
[[Bild:Pfeil.gif]][[Carbonyl-Gruppe: Lösung|Lösung]] | [[Bild:Pfeil.gif]][[Carbonyl-Gruppe: Lösung|Lösung]] | ||
| + | [[Kategorie:Experiment]] | ||
==Aufgaben== | ==Aufgaben== | ||
| − | # Vergleiche die C=C-Zweifachbindung mit der C=O-Zweifachbindung hinsichtlich Bindungslänge, Bindungsenergie und Polarität. | + | # Vergleiche die C=C-Zweifachbindung mit der C=O-Zweifachbindung hinsichtlich Bindungslänge, Bindungsenergie und [[Polarität]]. |
# Vergleiche Alkane, Alkanole und Alkanale hinsichtlich ihrer Siedetemperatur und ihrer Wasserlöslichkeit. Begründe Deine Aussagen. | # Vergleiche Alkane, Alkanole und Alkanale hinsichtlich ihrer Siedetemperatur und ihrer Wasserlöslichkeit. Begründe Deine Aussagen. | ||
[[Bild:Pfeil.gif]][[Carbonyl-Gruppe: Lösung|Lösungen]] | [[Bild:Pfeil.gif]][[Carbonyl-Gruppe: Lösung|Lösungen]] | ||
| − | + | {{cb|-|262|106}} | |
| − | + | {{www2}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
* http://www-oc.chemie.uni-regensburg.de/OCP/bio/oc2/ws02/Vorlsg-kap04.pdf | * http://www-oc.chemie.uni-regensburg.de/OCP/bio/oc2/ws02/Vorlsg-kap04.pdf | ||
| − | + | {{Ex-ch|265|1|Unterscheidung von Aldehyden und Ketonen}} | |
| − | + | {{Ex-ch09|{{fb|322}}|1|Redoxreaktionen von Carbonyl-Verbindungen|Unterscheidung von Aldehyden und Ketonen}} | |
| − | + | {{Ex-ch09|{{fb|322}}|2|Redoxreaktionen von Carbonyl-Verbindungen|Ameisensäure und Essigsäure im Vergleich}} | |
| + | {{Ex-ch09|{{fb|322}}|3|Redoxreaktionen von Carbonyl-Verbindungen|Synthese von Essigsäure}} | ||
| + | {{Ex-ch09|{{fb|332}}|1|Derivate der Carbonsäuren|Reaktivität von Carbonyl-Verbindungen}} | ||
#[[Benutzer:julemaus|Julia]] | #[[Benutzer:julemaus|Julia]] | ||
#[[Benutzer:Sandy|Sandy]] | #[[Benutzer:Sandy|Sandy]] | ||
| − | |||
[[Kategorie:Chemie]][[Kategorie:Chemikalien]] | [[Kategorie:Chemie]][[Kategorie:Chemikalien]] | ||
Aktuelle Version vom 12. Dezember 2016, 21:22 Uhr
| Carbonylgruppe | ||
|---|---|---|
| vernetzte Artikel | ||
| Aldehyde | Ketone | |
Inhaltsverzeichnis
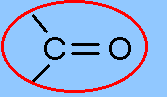
Definition
Carbonylgruppen sind funktionelle Gruppen in organischen Verbindungen. Sie bestehen aus einem Kohlenstoff- und einem Sauerstoffatom, die durch eine C=O-Doppelbindung verknüpft sind.
Die wichtigsten Carbonylgruppen
| Strukturformel | ||
|---|---|---|
| Aldehyde | 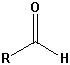 |
|
| Ketone | 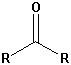 |
|
| Carbonsäuren | 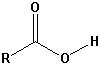 |
|
| Ester | 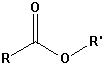 |
|
| Amid |  |
Man kann diese Carbonylverbindungen in zwei Untergruppen einteilen:
Aldehyde und Ketone können keine negative Ladung tragen, denn sie besitzen weder ein H-Atom noch eine Alkyl- oder Aryl-Gruppe. Aus diesem Grund können sie auch nicht als Abgabgsgruppe dienen.
Aldehyde und Ketone verfügen über ähnliche chemische Eigenschaften wie Carbonsäurederivate, unterscheiden sich aber dennoch von ihnen.
2. Acyl-Rest (RCO) in Carbonsäuren und ihre Derivate
Acyl-Rest (RCO) in Carbonsäuren und ihre Derivate sind elektronegative Heteroatome, sie tragen also eine negative Ladung und können aus diesem Grund als Abgangsgruppe dienen. Die Chemie dieser Carbonylverbindungen ist deshalb untereinander ähnlich, weisen aber dennoch einige Unterschiede in ihren chemischen Eigenschaften auf.
Carbonylverbindungen
Aldehyde und Ketone werden als Carbonylverbindungen bezeichnet, da sie beide die Carbonylgruppe als Strukturelement besitzen. Carbonylverbindungen mit einer endständigen Carbonyl-Gruppe werden als Aldehyde bezeichnet. Verbindungen, bei denen die Carbonyl-Gruppe nicht endständig ist, heißen Ketone.
Sie sind auch in der Natur zu finden, zum Beispiel spielen 28 verschiedene Carbonylverbindungen und deren Derivate eine große Rolle als Duftstoffe von Erdbeeren, Wein und auch Blumen.
Formaldehyd und seine Verwendung
Additionsreaktionen
Als ungesättigte Verbindungen sind Aldehyde und Ketone reaktionsfreudig. Es kommt zu sogenannten Additionsreaktionen, wobei die nucleophile Addition mit Oxonium-Ionen charakteristisch ist. Als Reaktionspartner dienen hierbei Alkohole, Wasser und Anionen.
Die Addition von Alkoholen an Carbonyl-Verbindungen läuft in zwei Schritten ab:
1. Schritt:
Das Sauerstoff-Atom der Carbonylgruppe wird protoniert, d. h. ein Proton angelagert, wodurch es eine positive Ladung bekommt. Mit dem freien Elektronenpaar seines Sauerstoff-Atoms greift das nucleophile Alkohol-Molekül nun das Carbonyl-C-Atom an. Durch Protonabgabe dieser Zwischenstufe wird so aus einem Aldehyd ein Halbacetal, aus einem Keton bildet sich auf diesem Weg ein Halbketal. Diese Moleküle besitzen die Eigenschaft, dass an einem ihrer C-Atome eine OH- sowie eine Ether-Gruppe sitzt.
2. Schritt:
In diesem Schritt wird zunächst die OH-Gruppe des Halbacetals/Halbketals protoniert und dann ein H2O-Molekül eliminiert. Folge: ein Acetal/Ketal entsteht. Ihre Bildung ist häufig durch ihren angenehmen Geruch erkennbar.
Oxidation & Reduktion der Carbonyl-Gruppe
Die mittlere Oxidationszahl des Kohlenstoffs in der Carbonyl-Gruppe (in Aldehyden: I, bei Ketonen II) lässt sowohl eine Oxidation (Erhöhung der Oxidationszahl) als auch eine Reduktion (Abnahme der Oxidationszahl) zu. Aldehyde lassen sich vergleichsweise gut oxidieren, bei Ketonen (Oxidationszahl II) funktioniert dies nur, wenn zuvor Bindungen gespalten wurden. Ketone wiederum lassen leichter reduzieren, da sie die Oxidationszahl II besitzenen. Auf diesem Wege kann gut experimentell zwischen Aldehyden und Ketonen unterschieden werden (siehe Versuch).
Versuch
Die FEHLING-Probe:
Geeignet für die Durchführung in kleinen Gruppen (3-4 Personen)
Geräte:
- Becherglas (250 ml)
- Kunststoffspritze (5 ml)
- Reagenzgläser
Chemikalien:
- Fehlingsche Lösung I und II
- Propionaldehyd (1 ml)
- Glucose-Lösung
- Aceton
Sicherheitsmaßnahmen:
- Schutzbrille
- evtl. Schutzhandschuhe
Durchführung:
- Ein Gemisch aus je 5 ml FEHLING-Lösung I und II und 1 ml Propionaldehyd wird in einem Becherglas erhitzt.
- Der Versuchsaufbau wird noch einmal genau so nachgestellt, diesmal jedoch anstatt Propionaldehyd Glucose-Lösung verwenden.
Zu beantworten:
- Welche Beobachtungen machst Du?
- Wie lässt sich die Reaktion erklären?
Aufgaben
- Vergleiche die C=C-Zweifachbindung mit der C=O-Zweifachbindung hinsichtlich Bindungslänge, Bindungsenergie und Polarität.
- Vergleiche Alkane, Alkanole und Alkanale hinsichtlich ihrer Siedetemperatur und ihrer Wasserlöslichkeit. Begründe Deine Aussagen.
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Carbonylgruppe: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Experimente und weitere Informationen zum Thema
- {{{1}}} als Google-Suchbegriff
- {{{1}}} in der Wikipedia
- {{{1}}} hier in bs-wiki.de mit Google
- {{{1}}} als Youtube-Video
- http://www-oc.chemie.uni-regensburg.de/OCP/bio/oc2/ws02/Vorlsg-kap04.pdf
- Unterscheidung von Aldehyden und Ketonen, in: Chemie heute (Ausgabe 1998), Seite 265, Versuch 1
- Redoxreaktionen von Carbonyl-Verbindungen: Unterscheidung von Aldehyden und Ketonen, in: Chemie heute SII, Seite 322, Versuch 1
- Redoxreaktionen von Carbonyl-Verbindungen: Ameisensäure und Essigsäure im Vergleich, in: Chemie heute SII, Seite 322, Versuch 2
- Redoxreaktionen von Carbonyl-Verbindungen: Synthese von Essigsäure, in: Chemie heute SII, Seite 322, Versuch 3
- Derivate der Carbonsäuren: Reaktivität von Carbonyl-Verbindungen, in: Chemie heute SII, Seite 332, Versuch 1