Polarität: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) (Die Seite wurde neu angelegt: „{{navi|Chemische Bindung|Atombindung}} Die Polarität oder Polarisierung einer Atombindung ergibt sich aus der Elektronegativitätsdifferenz (ΔEN…“) |
Dg (Diskussion | Beiträge) |
||
| Zeile 1: | Zeile 1: | ||
{{navi|Chemische Bindung|Atombindung}} | {{navi|Chemische Bindung|Atombindung}} | ||
| − | Die Polarität oder Polarisierung einer [[Atombindung]] ergibt sich aus der [[Elektronegativität]]sdifferenz (Δ[[EN]] der Bindungspartner. Hierdurch stellt sich eine Ladungsverschiebung in Richtung des [[Elektronegativität|elektronegativeren]] Atoms ein. | + | Die Polarität oder Polarisierung einer [[Atombindung]] ergibt sich aus der [[Elektronegativität]]sdifferenz (Δ[[EN]] der Bindungspartner. Hierdurch stellt sich eine Ladungsverschiebung in Richtung des [[Elektronegativität|elektronegativeren]] Atoms ein. In der Strukturformel wird diese Ladungsverschiebung durch ein keilförmig '''Δ''' gezeichnetes Elektronenpaar dargestellt. Das breite Ende des Keils symbolisiert eine höhere Aufenthaltswahrscheinlichkeit der Bindungselektronen beim stärker elektronegativen Atom. |
| + | [[Bild:Wasser-Dipol.png|thumb|398px|[[Wasser|H<sub>2</sub>O]] - ein Molekül mit polarisierter Atombindung]] | ||
| + | |||
| + | Beispiel: | ||
| + | Innerhalb eines [[Wasser|H<sub>2</sub>O]]-[[Molekül]]s werden die Elektronegativitäten der Bindungspartner verglichen und die Elektronegativitätsdifferenz berechnet: | ||
| + | * EN(H) = 2,1 | ||
| + | * EN(O) = 3,5 | ||
| + | * ΔEN = 1,4 | ||
| + | * Ladungsverschiebung in Richtung des elektronegativeren [[Sauerstoff]]-Atoms unter Ausbildung von Partialladungen {{rot|δ<sup>+</sup>}} u. {{blau|δ<sup>-</sup>}} | ||
Je nach Größe der Elektronegativitätsdifferenz werden unterschieden: | Je nach Größe der Elektronegativitätsdifferenz werden unterschieden: | ||
Version vom 12. Dezember 2016, 21:58 Uhr
| Polarität | ||
|---|---|---|
| vernetzte Artikel | ||
| Chemische Bindung | Atombindung | |
Die Polarität oder Polarisierung einer Atombindung ergibt sich aus der Elektronegativitätsdifferenz (ΔEN der Bindungspartner. Hierdurch stellt sich eine Ladungsverschiebung in Richtung des elektronegativeren Atoms ein. In der Strukturformel wird diese Ladungsverschiebung durch ein keilförmig Δ gezeichnetes Elektronenpaar dargestellt. Das breite Ende des Keils symbolisiert eine höhere Aufenthaltswahrscheinlichkeit der Bindungselektronen beim stärker elektronegativen Atom.
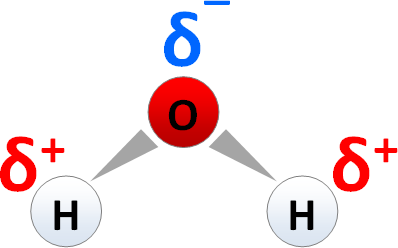
H2O - ein Molekül mit polarisierter Atombindung
Beispiel: Innerhalb eines H2O-Moleküls werden die Elektronegativitäten der Bindungspartner verglichen und die Elektronegativitätsdifferenz berechnet:
- EN(H) = 2,1
- EN(O) = 3,5
- ΔEN = 1,4
- Ladungsverschiebung in Richtung des elektronegativeren Sauerstoff-Atoms unter Ausbildung von Partialladungen δ+ u. δ-
Je nach Größe der Elektronegativitätsdifferenz werden unterschieden:
| ΔEN | < 0,5 | 0,5 - 1,7 | > 1,7 |
|---|---|---|---|
| Bindung | unpolar | polar | Ionenbindung |
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Polarität: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |



