Ester: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| Zeile 10: | Zeile 10: | ||
[[Bild:Ester.jpg|Die Entstehung von Estern]] | [[Bild:Ester.jpg|Die Entstehung von Estern]] | ||
=== Esterspaltung === | === Esterspaltung === | ||
| − | Die Umkehrung (= Rückreaktion) der Veresterung ist die Esterspaltung (=Esterhydrolyse). Da beide Reaktionen gleichzeitig ablaufen, spricht man von einer [[Gleichgewichtsreaktion]]. | + | Die Umkehrung (= Rückreaktion) der Veresterung ist die Esterspaltung (= Esterhydrolyse). Da beide Reaktionen gleichzeitig ablaufen, spricht man von einer [[Gleichgewichtsreaktion]]. |
== Beispiele == | == Beispiele == | ||
| Zeile 28: | Zeile 28: | ||
* Versuchsanleitung der Fa. Conatex zum Thema {{PAGENAME}} als PDF-Datei zum Download:<br>[http://www.conatex{{c}}mediapool/versuchsanleitungen/VAD_Chemie_Ester.pdf „Chemie riecht gut.“] | * Versuchsanleitung der Fa. Conatex zum Thema {{PAGENAME}} als PDF-Datei zum Download:<br>[http://www.conatex{{c}}mediapool/versuchsanleitungen/VAD_Chemie_Ester.pdf „Chemie riecht gut.“] | ||
* [http://www.seilnacht{{c}}Download/Abester.doc Thomas Seilnacht: Die Herstellung von Aromastoffen] | * [http://www.seilnacht{{c}}Download/Abester.doc Thomas Seilnacht: Die Herstellung von Aromastoffen] | ||
| − | * zwei Varianten zur Herstellung von Essigsäurepentylester (Birnengeruch) aus 1-Pentanol und Essigsäure mittels:<br />[http://www.educ.ethz.ch/unt/um/che/boc/fruchtester/index - Schwefelsäure (Urs Wuthier, ETH Zürich)]<br />[http://www.chids.de/dachs/praktikumsprotokolle/PP0212Veresterung.pdf - wasserfreies [[Zinkchlorid]] (Christian Lego, Uni Marburg)] | + | * zwei Varianten zur Herstellung von Essigsäurepentylester (Birnengeruch) aus [[Pentanol|1-Pentanol]] und Essigsäure mittels:<br />[http://www.educ.ethz.ch/unt/um/che/boc/fruchtester/index - Schwefelsäure (Urs Wuthier, ETH Zürich)]<br />[http://www.chids.de/dachs/praktikumsprotokolle/PP0212Veresterung.pdf - wasserfreies [[Zinkchlorid]] (Christian Lego, Uni Marburg)] |
[[Kategorie:Chemie]][[Kategorie:Chemikalien]] | [[Kategorie:Chemie]][[Kategorie:Chemikalien]] | ||
Version vom 24. Oktober 2014, 16:03 Uhr
Inhaltsverzeichnis
Was sind Ester?
Als Ester bezeichnet man die Stoffgruppe mit der funktionellen COOR-Gruppe (R= Kohlenwasserstoffrest).
Beispiel: Essigsäureethylester 
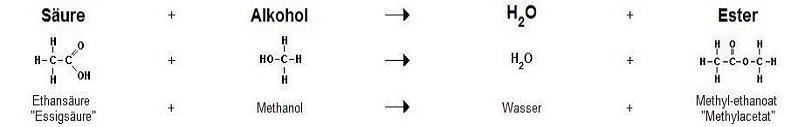
Veresterung
Ester entstehen bei der Reaktion von Alkoholen mit Carbonsäuren oder anorganischen Säuren bei gleichzeitiger Abspaltung von Wasser (Kondensationsreaktion, hier: Dehydratisierung). Ihre funktionelle Gruppe ist die COOR-Gruppe (R= Kohlenwasserstoffrest):
Esterspaltung
Die Umkehrung (= Rückreaktion) der Veresterung ist die Esterspaltung (= Esterhydrolyse). Da beide Reaktionen gleichzeitig ablaufen, spricht man von einer Gleichgewichtsreaktion.
Beispiele
- Die Ester der niederen Fettsäuren (1-7 Kohlenstoffatome) nutzt man auch in der Parfüm- und Duftherstellung. Z. B. zeichnen sich die Ester der übelriechenden Buttersäure durch fruchtartigen Geruch aus.
- Fette
- Sekundenkleber
Experimente
- Aromastoffe, in: Chemie heute (Ausgabe 1998), Seite 274, Versuch 1
- Essigsäureethylester
- Estergleichgewicht, in: Chemie heute (Ausgabe 1998), Seite 96, Versuch 3
- Veresterung und Esterspaltung, in: Elemente Chemie 2, Seite 118, Versuch 1-5
- Veresterung und Esterspaltung, in: Elemente Chemie 2, Seite 144, Versuch 1
- Veresterung und Esterspaltung, in: Elemente Chemie 2, Seite 146, Versuch 1
Weblinks
- Ester als Google-Suchbegriff
- Ester in der Wikipedia
- Ester hier in bs-wiki.de mit Google
- Ester als Youtube-Video
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Ester: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
- Versuchsanleitung der Fa. Conatex zum Thema Ester als PDF-Datei zum Download:
„Chemie riecht gut.“ - Thomas Seilnacht: Die Herstellung von Aromastoffen
- zwei Varianten zur Herstellung von Essigsäurepentylester (Birnengeruch) aus 1-Pentanol und Essigsäure mittels:
- Schwefelsäure (Urs Wuthier, ETH Zürich)
- wasserfreies Zinkchlorid (Christian Lego, Uni Marburg)