Polarität: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) (Die Seite wurde neu angelegt: „{{navi|Chemische Bindung|Atombindung}} Die Polarität oder Polarisierung einer Atombindung ergibt sich aus der Elektronegativitätsdifferenz (ΔEN…“) |
Dg (Diskussion | Beiträge) |
||
| (7 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
{{navi|Chemische Bindung|Atombindung}} | {{navi|Chemische Bindung|Atombindung}} | ||
| − | Die Polarität oder Polarisierung einer [[Atombindung]] ergibt sich aus der [[Elektronegativität]]sdifferenz (Δ[[EN]] der Bindungspartner. Hierdurch stellt sich eine Ladungsverschiebung in Richtung des [[Elektronegativität|elektronegativeren]] Atoms ein. | + | Die Polarität oder Polarisierung einer [[Atombindung]] ergibt sich aus der [[Elektronegativität]]sdifferenz (Δ[[EN]] der Bindungspartner. Hierdurch stellt sich eine Ladungsverschiebung in Richtung des [[Elektronegativität|elektronegativeren]] Atoms ein. In der Strukturformel wird diese Ladungsverschiebung durch ein keilförmig '''Δ''' gezeichnetes Elektronenpaar dargestellt. Das breite Ende des Keils symbolisiert eine höhere Aufenthaltswahrscheinlichkeit der Bindungselektronen beim stärker elektronegativen Atom. |
| + | [[Bild:Wasser-Dipol.png|thumb|398px|[[Wasser|H<sub>2</sub>O]] - ein Molekül mit polarisierter Atombindung]] | ||
Je nach Größe der Elektronegativitätsdifferenz werden unterschieden: | Je nach Größe der Elektronegativitätsdifferenz werden unterschieden: | ||
| Zeile 14: | Zeile 15: | ||
| polar | | polar | ||
| [[Ionenbindung]] | | [[Ionenbindung]] | ||
| + | |- | ||
| + | ! Beispiel | ||
| + | | [[Methan|CH<sub>4</sub>]] | ||
| + | | [[Wasser|H<sub>2</sub>O]] | ||
| + | | [[Natriumchlorid|NaCl]] | ||
|} | |} | ||
| − | {{cb|33| | + | Beispiel: |
| + | Innerhalb eines [[Wasser|H<sub>2</sub>O]]-[[Molekül]]s werden die Elektronegativitäten der Bindungspartner verglichen und die Elektronegativitätsdifferenz berechnet: | ||
| + | * EN(H) = 2,1 | ||
| + | * EN(O) = 3,5 | ||
| + | * ΔEN = 1,4 | ||
| + | * Ladungsverschiebung in Richtung des elektronegativeren [[Sauerstoff]]-Atoms | ||
| + | * Ausbildung von Partialladungen {{rot|δ<sup>+</sup>}} u. {{blau|δ<sup>-</sup>}} | ||
| + | == Warum muss ich das wissen? == | ||
| + | * Ein wesentliches Konzept in der Chemie ist das [[Struktur-Eigenschafts-Konzept]]. Am Beispiel Polarisierung einer [[Atombindung]] kannst Du dieses Konzept kennenlernen. | ||
| + | * Durch Analyse der Ladungsverteilung innerhalb eines Moleküls lassen sich Stoffeigenschaften wie Siedetemperatur und Löslichkeit vorhersagen, siehe [[Dipol]]. | ||
| + | {{cb|33|46|30}} | ||
{{www}} | {{www}} | ||
*[http://www.br-online.de/wissen-bildung/telekolleg/faecher/chemie/chemie_03/ Telekolleg Chemie - 3. Folge: Stoffe mit Elektronenpaarbindung] | *[http://www.br-online.de/wissen-bildung/telekolleg/faecher/chemie/chemie_03/ Telekolleg Chemie - 3. Folge: Stoffe mit Elektronenpaarbindung] | ||
Aktuelle Version vom 12. Dezember 2016, 22:14 Uhr
| Polarität | ||
|---|---|---|
| vernetzte Artikel | ||
| Chemische Bindung | Atombindung | |
Die Polarität oder Polarisierung einer Atombindung ergibt sich aus der Elektronegativitätsdifferenz (ΔEN der Bindungspartner. Hierdurch stellt sich eine Ladungsverschiebung in Richtung des elektronegativeren Atoms ein. In der Strukturformel wird diese Ladungsverschiebung durch ein keilförmig Δ gezeichnetes Elektronenpaar dargestellt. Das breite Ende des Keils symbolisiert eine höhere Aufenthaltswahrscheinlichkeit der Bindungselektronen beim stärker elektronegativen Atom.
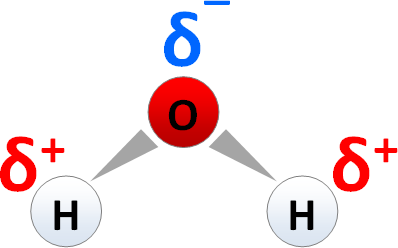
H2O - ein Molekül mit polarisierter Atombindung
Je nach Größe der Elektronegativitätsdifferenz werden unterschieden:
| ΔEN | < 0,5 | 0,5 - 1,7 | > 1,7 |
|---|---|---|---|
| Bindung | unpolar | polar | Ionenbindung |
| Beispiel | CH4 | H2O | NaCl |
Beispiel: Innerhalb eines H2O-Moleküls werden die Elektronegativitäten der Bindungspartner verglichen und die Elektronegativitätsdifferenz berechnet:
- EN(H) = 2,1
- EN(O) = 3,5
- ΔEN = 1,4
- Ladungsverschiebung in Richtung des elektronegativeren Sauerstoff-Atoms
- Ausbildung von Partialladungen δ+ u. δ-
Warum muss ich das wissen?
- Ein wesentliches Konzept in der Chemie ist das Struktur-Eigenschafts-Konzept. Am Beispiel Polarisierung einer Atombindung kannst Du dieses Konzept kennenlernen.
- Durch Analyse der Ladungsverteilung innerhalb eines Moleküls lassen sich Stoffeigenschaften wie Siedetemperatur und Löslichkeit vorhersagen, siehe Dipol.
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Polarität: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |



