Ozon: Unterschied zwischen den Versionen
Tina (Diskussion | Beiträge) (→Lösungsansätze) |
Dg (Diskussion | Beiträge) |
||
| (42 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | + | {{navi|Atmosphäre|Luft}} | |
| − | Ozon (griechisch ozein: „das Duftende“) ist bei Zimmertemperatur und unter normalem Luftdruck ein blassblaues, | + | == Chemische Grundlagen == |
| − | + | [[Bild:Ozon2.jpg|thumb|200px|'''O<sub>2</sub> → 2 O∙'''<br />Bild 1: Aufspaltung von Sauerstoffmolekülen zu Radikalen]] | |
| + | Ozon (griechisch ''ozein'': „das Duftende“) ist bei Zimmertemperatur und unter [[Normaldruck|normalem Luftdruck]] ein blassblaues, [[giftig]]es Gas mit durchdringendem Geruch. | ||
| − | + | Es ist eine besondere Form von [[Sauerstoff]], seine [[Molekül]]e sind im Gegensatz zu biatomaren Sauerstoff (O<sub>2</sub>) '''aus drei Sauerstoffatomen aufgebaut''', daher die Formel '''O<sub>3</sub>'''. O. ist eines der stärksten bekannten [[Oxidationsmittel]], es oxidiert [[Indigo]] zu gelbem Isatin – hierauf beruht der Nachweis in Dräger-Prüfröhrchen, siehe [[Ozon: Experimente|Nachweis von Ozon]]. | |
| + | [[Bild:Ozon3.jpg|thumb|200px|'''O∙ + O<sub>2</sub> → O<sub>3</sub>'''<br />Bild 2: Bildung von Ozon]] | ||
| − | + | === Entstehung === | |
| − | + | * '''Bild 1:''' Unter der Einwirkung des [[Ultraviolette Strahlung|UV-Lichts]] der Sonne, aber auch bei elektrischen Entladungen, z. B. bei Gewittern, wird das "normale", also biatomare Sauerstoffmolekül aufgespalten, dabei entstehen zwei einzelne Sauerstoffatome (Sauerstoffradikale, O∙). | |
| + | * '''Bild 2:''' Die einzelnen Sauerstoffatome sind extrem reaktionsfreudig und verbinden sich mit einem verbleibenden Sauerstoffmolekül zum O<sub>3</sub>-Molekül Ozon. | ||
| + | === Physiologische Wirkung === | ||
| + | |||
| + | Folgen einer zu hohen Ozondosis: | ||
| − | + | *Kopfschmerzen und Mattigkeit | |
| + | *Reizwirkungen auf die Augen (Bindehautentzündung) | ||
| + | *Atembeschwerden bei Säuglingen und Kleinkindern, bei Patienten mit Asthma bronchial, Chronische Bronchitis und Herz-Kreislauf-Beschwerden | ||
| − | [[ | + | == Verwendung == |
| − | + | * Ozon wird zum Entfernen von Substanzen und Pharmazeutika genutzt, die im Abwasser und sogar im [[Trinkwasser]] vorkommen. | |
| + | * Zusammen mit UV-Licht wird das Ozon auch zur [[Trinkwasser]]aufbereitung verwendet, da Ozon keimtötend wirkt. | ||
| + | [[Bild:Atmosphaere.jpg|right]] | ||
| − | + | == Ozon in der Atmosphäre == | |
| + | Ozon kommt in verschiedenen Schichten der [[Atmosphäre]] als [[Spurengas]] vor. Wesentlich für die kontroverse Diskussion um atmosphärisches Ozon ist die unterschiedliche Bedeutung des Ozons in Bodennähe (Troposphäre) und in der sogenannten [[Ozon#Stratosph.C3.A4re_.28atmosph.C3.A4risches_Ozon.29|Ozonschicht der Stratosphäre]]. | ||
| + | === Troposphäre (bodennahes Ozon)=== | ||
| − | + | Da Ozon reaktionsfreudiger ist als gewöhnlicher Sauerstoff ist, wirkt Ozon in Bodennähe als Reizgas auf Organismen und erhöht durch die stärkere [[Oxidation]]swirkung z. B. die Alterung von Gummi in Autoreifen. Eine Ozonkonzentration über dem Grenzwert von 120 μg/m³ gilt sogar als schädigend für Menschen, Pflanzen und Tiere, siehe ''physiologische Wirkung''. | |
| − | == | + | ==== Auf- und Abbau von Ozon ==== |
| − | + | Ein interessantes Phänomen ist, dass im Sommer in Reinluftgebieten sogar eine höhere Ozon-[[Konzentration]] erreicht wird als in den Städten. Neben der [[Ozon#Entstehung|UV-Strahlung]] wird die Konzentration von bodennahem Ozon von zwei Komponenten bestimmt, den [[Stickoxide]]n und [[Kohlenwasserstoffe]]n: | |
| + | '''Einfluss der Stickoxide''' | ||
| − | + | Einen wesentlichen Einfluss auf bodennahes Ozon haben die verschiedenen [[Stickoxide]], die bei der Verbrennung von [[fossile Brennstoffe|fossilen Brennstoffen]] entstehen, z. B. [[Stickstoffdioxid]] (NO<sub>2</sub>) und Stickstoffmonoxid (NO) aus Abgasen im Straßenverkehr und der Industrie. In Abhängigkeit von der Tageszeit bzw. Intensität der Sonnenstrahlung stehen die folgenden [[Chemische Reaktionen|chemischen Reaktionen]] in Konkurrenz zueinander: | |
| − | NO<sub>2</sub> + UV-Strahlung → NO∙ + O∙ (Reaktion 1 | + | Ozonbildung durch Stickstoff'''di'''oxid, z. B. durch morgendlichen Berufsverkehr in den Ballungszentren: |
| + | NO<sub>2</sub> + UV-Strahlung → NO∙ + O∙ (Reaktion 1: NO<sub>2</sub> wird durch die UV-Strahlung zu Radikalen gespalten. | ||
| − | O∙ + O<sub>2</sub> → O<sub>3</sub> (Reaktion 2) | + | O∙ + O<sub>2</sub> → O<sub>3</sub> (Reaktion 2: Ozonbildung - das Sauerstoffradikal verbindet sich mit einem Sauerstoffmolekül (O<sub>2</sub>) zu Ozon) |
| − | + | Die gestiegene Konzentration von Stickstoff'''mon'''oxid (NO) führt im weiteren Verlauf des Tages zu Ozonabbau: | |
| + | O<sub>3</sub> + NO∙ → NO<sub>2</sub> + O<sub>2</sub> (Reaktion 3: Ozonabbau) | ||
| − | + | Je stärker die Sonne scheint, desto mehr Ozon wird gebildet und umso stärker wird NO<sub>2</sub> abgebaut. | |
| − | |||
| + | '''Abbau der Stickoxide durch Kohlenwasserstoffe''' | ||
| − | In der Atmosphäre befinden sich auch [[Kohlenwasserstoffe]], | + | In der Atmosphäre befinden sich auch flüchtige [[organische Verbindung]]en wie unverbrannte [[Kohlenwasserstoffe]] (HC), z. B. aus dem Abgas im Straßenverkehr. HC reagieren mit OH-Radikalen zu Peroxid-Radikalen R-O-O{{*}}. Die Peroxid-Radikale oxidieren NO∙ zu NO<sub>2</sub>, ohne dass dabei O<sub>3</sub> verbraucht wird. |
R-O-O∙ + NO → R-O∙ + NO<sub>2</sub> (Reaktion 4) | R-O-O∙ + NO → R-O∙ + NO<sub>2</sub> (Reaktion 4) | ||
| − | + | In reiner Luft kann demnach Ozon nur langsamer abgebaut werden. Langanhaltend hohe Ozonbelastungen können also gerade in verkehrsarmen Gegenden auftreten, da nur in Städten die Autoabgase dafür sorgen, dass nachts wiederum die Ozonkonzentration sinkt. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | === Stratosphäre (atmosphärisches Ozon)=== | |
| − | In der Stratosphäre | + | In der von 15-50 km über der Erde reichenden Gasschicht, der sogenannten Stratosphäre, befindet sich in ca. 30 km Höhe eine Gasschicht mit besonders viel Ozon ("Ozonschicht", mit ca. 10 ppm Ozonanteil). Die Ozonschicht ist wichtig für die Erde, da sie wie ein Filter wirkt und die harten ultravioletten Sonnenstrahlen absorbiert. Hierbei wird eun erheblicher Anteil des UV-Lichtes daran gehindert, bis zur Erdoberfläche durchzudringen. Somit schützt sie also Menschen, Tiere und Pflanzen. Die übrig gebliebene UV-Strahlung, die die Oberfläche erreicht, kann jedoch, bei entsprechender Dosis zu Sonnenbrand bishin zum Hautkrebs führen. |
| − | + | In der Stratosphäre herrscht normalerweise ein Gleichgewicht zwischen dem natürlichen Ab- und Aufbau des Ozons. Dieses Gleichgewicht wird jedoch von Fluor-Chlor-Kohlenwasserstoffen gestört. Durch diesen Ablauf wird die Ozonschicht geschädigt und somit kann man von einer Entstehung des Ozonlochs reden. | |
| − | |||
[[Bild:Ozonj aus.jpg|thumb|Abbau des Ozons]] | [[Bild:Ozonj aus.jpg|thumb|Abbau des Ozons]] | ||
| + | ==== Ozonloch ==== | ||
[[Bild:Bildung1.jpg|thumb|Die Bildung des Chlormonoxidradikals]] | [[Bild:Bildung1.jpg|thumb|Die Bildung des Chlormonoxidradikals]] | ||
[[Bild:Bildung2.jpg|thumb|Die Bildung des Sauerstoffmoleküls]] | [[Bild:Bildung2.jpg|thumb|Die Bildung des Sauerstoffmoleküls]] | ||
| − | + | Beim natürlichen Auf- und Abbau des Ozons entsteht in der Stratosphäre ein Gleichgewicht. Dieses Gleichgewicht wird von [[Fluorchlorkohlenwasserstoffe]]n gestört. Sie tragen dazu bei, dass mehr Ozon zersetzt wird als das sich Neues bilden kann. Durch Luftbewegungen in der Atmosphäre verteilen sich die FCKW rund um die Erde. Da ihre Moleküle sehr stabil gegen äußere Einflüsse sind, verändern sie sich beim Kontakt mit anderen Molekülen nicht. In der Stratosphäre werden jedoch durch die intensive UV-Strahlung aus den FCKW reaktionsfähige Chlorradikale abgespalten. Diese wiederum greifen die Ozonmoleküle an und bewirken deren Umwandlung in Sauerstoffmoleküle. Dabei entsteht außerdem das radikale Chlormonooxid. | |
Durch die Ausdünnung der Ozonschicht gelangen vor allem UV-B-Strahlungen auf die Erde. Diese Strahlen stellen für alle Lebewesen eine große Bedrohung dar. | Durch die Ausdünnung der Ozonschicht gelangen vor allem UV-B-Strahlungen auf die Erde. Diese Strahlen stellen für alle Lebewesen eine große Bedrohung dar. | ||
| Zeile 87: | Zeile 84: | ||
* sie schädigt die Erbsubstanz, es wäre denkbar, dass die Menschen unfruchtbar werden, dass die Krebsrate ansteigt oder dass vermehrt Missbildungen vorkommen. | * sie schädigt die Erbsubstanz, es wäre denkbar, dass die Menschen unfruchtbar werden, dass die Krebsrate ansteigt oder dass vermehrt Missbildungen vorkommen. | ||
| − | == | + | == Zusammenfassung == |
| − | + | Das Ozon in der Stratosphäre ist besonders wichtig für uns, da es die UV-Strahlung absorbiert und somit die Menschen, Tiere und Pflanzen auf der Erde schützt. Dagegen ist das Ozon in der Troposphäre, wenn es in zu hohen Konzentrationen vorkommt, gesundheitsgefährdend. | |
| + | * '''Ozon hat eine nützliche Wirkung in der Stratosphäre, aber eine schädliche Wirkung in Bodennähe.''' | ||
| − | == Lösungsansätze == | + | === Lösungsansätze === |
* Verminderung verkehrsbedingte Emissionen von Stickoxiden, z.B. durch Fahrverbot an Sonntagen und Tempolimit auf den Autobahnen | * Verminderung verkehrsbedingte Emissionen von Stickoxiden, z.B. durch Fahrverbot an Sonntagen und Tempolimit auf den Autobahnen | ||
| − | * Bei der Stromerzeugung auf Solarenergie umstellen | + | * Bei der Stromerzeugung auf [[Solarenergie]] umstellen |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | * Verminderung der [[FCKW]]-Emissionen, z.B. durch Einsatz vonn FCKW-freien Kühlschränken | |
== Fragebogen == | == Fragebogen == | ||
| + | * [[Ozon: Fragebogen|Fragebogen zum Thema Ozon]] | ||
| + | * [[Ozon: Antworten|Antworten zum Fragebogen]] | ||
| − | [[Ozon: | + | == Experimente == |
| + | [[Ozon: Experimente|Experimente zum Thema Ozon]] | ||
| − | + | {{Sammlung}} | |
| − | + | {{cb|-|392|468}} | |
| − | + | {{www}} | |
| − | + | {{Blume|ozon}} | |
| − | + | * [http://www.umwelt.niedersachsen.de/master/C44768198_N41769412_L20_D0_I598.html Luftüberwachung in Niedersachsen mit aktuellen Ozon-Messwerten] | |
| − | |||
| − | * [http:// | ||
* [http://www.chemie.unterricht.ws/downloads/ozon.pdf Foliensatz] | * [http://www.chemie.unterricht.ws/downloads/ozon.pdf Foliensatz] | ||
| − | * [http://www.seilnacht | + | * [http://www.seilnacht{{c}}Lexikon/Ozon.htm Ozon und Ozonloch] |
| − | |||
* [http://www.physik.uni-oldenburg.de/Docs/puma/1624.html Bodennahes Ozon] | * [http://www.physik.uni-oldenburg.de/Docs/puma/1624.html Bodennahes Ozon] | ||
| − | |||
| − | |||
* [http://www.atmosphere.mpg.de/enid/Klima_kurz_gefasst/-_Stratosphaere_2l0.html Stratosphäre] | * [http://www.atmosphere.mpg.de/enid/Klima_kurz_gefasst/-_Stratosphaere_2l0.html Stratosphäre] | ||
* [http://www.atmosphere.mpg.de/enid/Basis/1__Die_Stratosphaere_verstehen_1m9.html Stratosphäre 2] | * [http://www.atmosphere.mpg.de/enid/Basis/1__Die_Stratosphaere_verstehen_1m9.html Stratosphäre 2] | ||
* [http://www.lanuv.nrw.de/veroeffentlichungen/infoblaetter/infoblatt2.pdf "Ozonloch" in der Stratosphäre?] | * [http://www.lanuv.nrw.de/veroeffentlichungen/infoblaetter/infoblatt2.pdf "Ozonloch" in der Stratosphäre?] | ||
| − | |||
| − | |||
[[Kategorie:Chemie]][[Kategorie:Chemikalien]] | [[Kategorie:Chemie]][[Kategorie:Chemikalien]] | ||
Aktuelle Version vom 20. September 2017, 10:42 Uhr
Inhaltsverzeichnis
Chemische Grundlagen
Ozon (griechisch ozein: „das Duftende“) ist bei Zimmertemperatur und unter normalem Luftdruck ein blassblaues, giftiges Gas mit durchdringendem Geruch.
Es ist eine besondere Form von Sauerstoff, seine Moleküle sind im Gegensatz zu biatomaren Sauerstoff (O2) aus drei Sauerstoffatomen aufgebaut, daher die Formel O3. O. ist eines der stärksten bekannten Oxidationsmittel, es oxidiert Indigo zu gelbem Isatin – hierauf beruht der Nachweis in Dräger-Prüfröhrchen, siehe Nachweis von Ozon.
Entstehung
- Bild 1: Unter der Einwirkung des UV-Lichts der Sonne, aber auch bei elektrischen Entladungen, z. B. bei Gewittern, wird das "normale", also biatomare Sauerstoffmolekül aufgespalten, dabei entstehen zwei einzelne Sauerstoffatome (Sauerstoffradikale, O∙).
- Bild 2: Die einzelnen Sauerstoffatome sind extrem reaktionsfreudig und verbinden sich mit einem verbleibenden Sauerstoffmolekül zum O3-Molekül Ozon.
Physiologische Wirkung
Folgen einer zu hohen Ozondosis:
- Kopfschmerzen und Mattigkeit
- Reizwirkungen auf die Augen (Bindehautentzündung)
- Atembeschwerden bei Säuglingen und Kleinkindern, bei Patienten mit Asthma bronchial, Chronische Bronchitis und Herz-Kreislauf-Beschwerden
Verwendung
- Ozon wird zum Entfernen von Substanzen und Pharmazeutika genutzt, die im Abwasser und sogar im Trinkwasser vorkommen.
- Zusammen mit UV-Licht wird das Ozon auch zur Trinkwasseraufbereitung verwendet, da Ozon keimtötend wirkt.
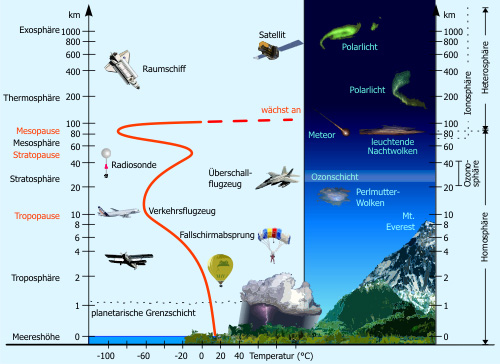
Ozon in der Atmosphäre
Ozon kommt in verschiedenen Schichten der Atmosphäre als Spurengas vor. Wesentlich für die kontroverse Diskussion um atmosphärisches Ozon ist die unterschiedliche Bedeutung des Ozons in Bodennähe (Troposphäre) und in der sogenannten Ozonschicht der Stratosphäre.
Troposphäre (bodennahes Ozon)
Da Ozon reaktionsfreudiger ist als gewöhnlicher Sauerstoff ist, wirkt Ozon in Bodennähe als Reizgas auf Organismen und erhöht durch die stärkere Oxidationswirkung z. B. die Alterung von Gummi in Autoreifen. Eine Ozonkonzentration über dem Grenzwert von 120 μg/m³ gilt sogar als schädigend für Menschen, Pflanzen und Tiere, siehe physiologische Wirkung.
Auf- und Abbau von Ozon
Ein interessantes Phänomen ist, dass im Sommer in Reinluftgebieten sogar eine höhere Ozon-Konzentration erreicht wird als in den Städten. Neben der UV-Strahlung wird die Konzentration von bodennahem Ozon von zwei Komponenten bestimmt, den Stickoxiden und Kohlenwasserstoffen:
Einfluss der Stickoxide
Einen wesentlichen Einfluss auf bodennahes Ozon haben die verschiedenen Stickoxide, die bei der Verbrennung von fossilen Brennstoffen entstehen, z. B. Stickstoffdioxid (NO2) und Stickstoffmonoxid (NO) aus Abgasen im Straßenverkehr und der Industrie. In Abhängigkeit von der Tageszeit bzw. Intensität der Sonnenstrahlung stehen die folgenden chemischen Reaktionen in Konkurrenz zueinander:
Ozonbildung durch Stickstoffdioxid, z. B. durch morgendlichen Berufsverkehr in den Ballungszentren:
NO2 + UV-Strahlung → NO∙ + O∙ (Reaktion 1: NO2 wird durch die UV-Strahlung zu Radikalen gespalten.
O∙ + O2 → O3 (Reaktion 2: Ozonbildung - das Sauerstoffradikal verbindet sich mit einem Sauerstoffmolekül (O2) zu Ozon)
Die gestiegene Konzentration von Stickstoffmonoxid (NO) führt im weiteren Verlauf des Tages zu Ozonabbau:
O3 + NO∙ → NO2 + O2 (Reaktion 3: Ozonabbau)
Je stärker die Sonne scheint, desto mehr Ozon wird gebildet und umso stärker wird NO2 abgebaut.
Abbau der Stickoxide durch Kohlenwasserstoffe
In der Atmosphäre befinden sich auch flüchtige organische Verbindungen wie unverbrannte Kohlenwasserstoffe (HC), z. B. aus dem Abgas im Straßenverkehr. HC reagieren mit OH-Radikalen zu Peroxid-Radikalen R-O-O · . Die Peroxid-Radikale oxidieren NO∙ zu NO2, ohne dass dabei O3 verbraucht wird.
R-O-O∙ + NO → R-O∙ + NO2 (Reaktion 4)
In reiner Luft kann demnach Ozon nur langsamer abgebaut werden. Langanhaltend hohe Ozonbelastungen können also gerade in verkehrsarmen Gegenden auftreten, da nur in Städten die Autoabgase dafür sorgen, dass nachts wiederum die Ozonkonzentration sinkt.
Stratosphäre (atmosphärisches Ozon)
In der von 15-50 km über der Erde reichenden Gasschicht, der sogenannten Stratosphäre, befindet sich in ca. 30 km Höhe eine Gasschicht mit besonders viel Ozon ("Ozonschicht", mit ca. 10 ppm Ozonanteil). Die Ozonschicht ist wichtig für die Erde, da sie wie ein Filter wirkt und die harten ultravioletten Sonnenstrahlen absorbiert. Hierbei wird eun erheblicher Anteil des UV-Lichtes daran gehindert, bis zur Erdoberfläche durchzudringen. Somit schützt sie also Menschen, Tiere und Pflanzen. Die übrig gebliebene UV-Strahlung, die die Oberfläche erreicht, kann jedoch, bei entsprechender Dosis zu Sonnenbrand bishin zum Hautkrebs führen.
In der Stratosphäre herrscht normalerweise ein Gleichgewicht zwischen dem natürlichen Ab- und Aufbau des Ozons. Dieses Gleichgewicht wird jedoch von Fluor-Chlor-Kohlenwasserstoffen gestört. Durch diesen Ablauf wird die Ozonschicht geschädigt und somit kann man von einer Entstehung des Ozonlochs reden.
Ozonloch
Beim natürlichen Auf- und Abbau des Ozons entsteht in der Stratosphäre ein Gleichgewicht. Dieses Gleichgewicht wird von Fluorchlorkohlenwasserstoffen gestört. Sie tragen dazu bei, dass mehr Ozon zersetzt wird als das sich Neues bilden kann. Durch Luftbewegungen in der Atmosphäre verteilen sich die FCKW rund um die Erde. Da ihre Moleküle sehr stabil gegen äußere Einflüsse sind, verändern sie sich beim Kontakt mit anderen Molekülen nicht. In der Stratosphäre werden jedoch durch die intensive UV-Strahlung aus den FCKW reaktionsfähige Chlorradikale abgespalten. Diese wiederum greifen die Ozonmoleküle an und bewirken deren Umwandlung in Sauerstoffmoleküle. Dabei entsteht außerdem das radikale Chlormonooxid.
Durch die Ausdünnung der Ozonschicht gelangen vor allem UV-B-Strahlungen auf die Erde. Diese Strahlen stellen für alle Lebewesen eine große Bedrohung dar.
- sie verursacht Sonnenbrände und Hautkrebs
- sie schädigt die Augen, fördert den grauen Star und kann bis zur Erblindung führen
- sie schwächt das Immunsystem
- sie schädigt die Erbsubstanz, es wäre denkbar, dass die Menschen unfruchtbar werden, dass die Krebsrate ansteigt oder dass vermehrt Missbildungen vorkommen.
Zusammenfassung
Das Ozon in der Stratosphäre ist besonders wichtig für uns, da es die UV-Strahlung absorbiert und somit die Menschen, Tiere und Pflanzen auf der Erde schützt. Dagegen ist das Ozon in der Troposphäre, wenn es in zu hohen Konzentrationen vorkommt, gesundheitsgefährdend.
- Ozon hat eine nützliche Wirkung in der Stratosphäre, aber eine schädliche Wirkung in Bodennähe.
Lösungsansätze
- Verminderung verkehrsbedingte Emissionen von Stickoxiden, z.B. durch Fahrverbot an Sonntagen und Tempolimit auf den Autobahnen
- Bei der Stromerzeugung auf Solarenergie umstellen
- Verminderung der FCKW-Emissionen, z.B. durch Einsatz vonn FCKW-freien Kühlschränken
Fragebogen
Experimente
Sicherheitshinweise
Bei der Verwendung von Ozon beim Experimentieren gilt:
| |
Auf Chemikalien-Gefäßen finden sich codierte Hinweise auf Gefährdungen und entsprechende Vorsorgemaßnahmen beim Umgang mit dieser Chemikalie. Diese sogenannten H- & P-Sätze hängen gemeinsam mit den Arbeitsregeln für Schülerexperimente als Betriebsanweisung im Chemieraum aus und müssen in jedem Fall beachtet werden! |
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Ozon: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Weblinks
- Ozon als Google-Suchbegriff
- Ozon in der Wikipedia
- Ozon hier in bs-wiki.de mit Google
- Ozon als Youtube-Video
- Prof. Rüdiger Blumes umfangreiche Themenseite mit Experimenten und weitergehenden Infos
- Luftüberwachung in Niedersachsen mit aktuellen Ozon-Messwerten
- Foliensatz
- Ozon und Ozonloch
- Bodennahes Ozon
- Stratosphäre
- Stratosphäre 2
- "Ozonloch" in der Stratosphäre?