Autoprotolyse: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) |
|||
| (46 dazwischenliegende Versionen von 3 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | + | {{navi|Säure-Base-Reaktionen|Brönsted-Theorie}} | |
| − | + | == Was versteht man unter Autoprotolyse? == | |
| − | |||
| − | + | Bestimmte Stoffe, die sowohl als [[Säure]] als auch als [[Base]] reagieren können nennt man Ampholyte. Einige dieser Stoffe reagieren auch als Säure und als Base mit sich selbst - sie protolysieren. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | Bestimmte Stoffe, die sowohl als Säure als auch als Base reagieren können nennt man Ampholyte. Einige dieser Stoffe reagieren auch als Säure und als Base mit sich selbst- sie protolysieren. | ||
Das bekannteste Beispiel hierfür ist das Wasser. | Das bekannteste Beispiel hierfür ist das Wasser. | ||
| − | Wenn eine Flüssigkeit eine Leitfähigkeit besitzt, so müssen in dieser Flüssigkeit Ionen (Atome die eine Ladung besitzen) vorliegen, durch deren Wanderung der Stromtransport stattfinden kann. | + | Wenn eine Flüssigkeit eine [[elektrische Leitfähigkeit]] besitzt, so müssen in dieser Flüssigkeit [[Ionen]] (Atome die eine Ladung besitzen) vorliegen, durch deren Wanderung der Stromtransport stattfinden kann. |
| − | Wirklich reines Wasser gibt es nicht. Selbst mehrfach destilliertes Wasser enthält immer noch Fremdteilchen, z.B. aus der Glaswand des Destillationskolbens. | + | Wirklich reines Wasser gibt es nicht. Selbst mehrfach [[destilliertes Wasser]] enthält immer noch Fremdteilchen, z. B. aus der Glaswand des Destillationskolbens und aus der Luft aufgenommenes CO<sub>2</sub>. |
| − | Aber selbst wenn es uns gelingen würde, absolut reines Wasser herzustellen, würden selbst dort Ionen in geringer Konzentration vorliegen. | + | Aber selbst wenn es uns gelingen würde, absolut reines Wasser herzustellen, würden selbst dort [[Ionen]] in geringer Konzentration vorliegen. |
| − | Diese Ionen entstehen durch | + | Diese [[Ionen]] entstehen durch [[Proton]]enübertragung von einem [[Wasser]][[molekül]] zum anderen. |
| − | Dieser Vorgang wird als Autoprotolyse bezeichnet (von griech. autos= "selbst"). | + | Dieser Vorgang wird als Autoprotolyse bezeichnet (von griech. ''autos'' = "selbst"). |
| + | == Die chemische Reaktion der Autoprotolyse == | ||
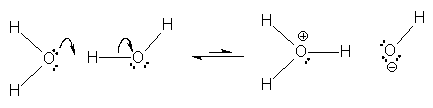
| − | + | Ein Wassermolekül wirkt also als Säure, ein Anderes als Base, d. h. eines von zwei Wassermolekülen gibt dem benachbarten [[Molekül]] ein [[Proton]] ab, welches von diesem Wassermolekül aufgenommen wird. | |
| − | + | ||
| − | + | Nach diesem ersten Schritt zieht das Proton aufgrund seiner positiven Ladung Wasser-Moleküle an und es entsteht das '''[[Oxonium]]-Ion''' (H<sub>3</sub>O<sup>+</sup>, veraltet auch als ''Hydronium'' oder ''Hydroxonium-Ion'' bezeichnet), welches aufgrund seiner Ladung das ebenfalls neu gebildete Hydroxid-Ion (OH<sup>-</sup>) anzieht. | |
| − | |||
| − | |||
| − | Ein Wassermolekül wirkt also als Säure, ein Anderes als Base, d.h. eines von zwei Wassermolekülen gibt | ||
| − | Nach | ||
[[Bild:Formel_10.gif]] | [[Bild:Formel_10.gif]] | ||
| + | == Das Massenwirkungsgesetz == | ||
| + | Für Wasser gilt: Die [[ Stoffmengenkonzentration|Konzentration ''c'']] der Oxonium- und Hydroxid[[ionen]] liegt bei 25°C bei je 10<sup>-7</sup>mol/L. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
Das Gleichgewicht dieser Reaktion liegt daher stark auf der linken Seite der Reaktion. | Das Gleichgewicht dieser Reaktion liegt daher stark auf der linken Seite der Reaktion. | ||
| − | Auf das Protolysegleichgewicht lässt sich das Massenwirkungsgesetz anwenden: | + | Auf das Protolysegleichgewicht lässt sich das [[Massenwirkungsgesetz]] anwenden: |
[[Bild:Texstring.png]] | [[Bild:Texstring.png]] | ||
| − | Ein Mol hat die Masse von 18 | + | Ein [[Mol]] hat die Masse von 18 g und ein Liter Wasser besitzt bei 25°C die Masse von 997 g. Daraus folgt, dass ein Liter Wasser 55,4 mol Wasser-Moleküle enthält. Die Wassermolekül-Konzentration beträgt also 55,4 mol/L. Die Konzentration der Hydroxid- und Oxonium[[ionen]] beträgt jeweils 10<sup>-7</sup>mol/L. |
| − | Wir setzen diese Werte nun in das Massenwirkungsgesetz ein( Erinnerung: die Konzentrationen der Ausgangsstoffe unter den Bruchstrich und die Konzentration der Produkte über dem Bruchstrich) | + | |
| + | Wir setzen diese Werte nun in das [[Massenwirkungsgesetz]] ein (Erinnerung: die Konzentrationen der Ausgangsstoffe unter den Bruchstrich und die [[Konzentration]] der Produkte über dem Bruchstrich). | ||
[[Bild: K texstring.png]] | [[Bild: K texstring.png]] | ||
| + | Das Produkt der Oxonium-[[Ionen]] und der Hydroxid-[[Ionen]] muss immer gleich sein. | ||
| − | + | Wenn die Konzentration der Hydroxid-[[Ionen]] z.B. von 10<sup>-7</sup> auf 10<sup>-4</sup> erhöht wird, so nimmt auch automatisch die [[Konzentration]] der Hydroxid-[[Ionen]] von 10<sup>-7</sup> auf 10<sup>-10</sup> ab, da das Produkt beider Konzentrationen immer konstant 10<sup>-14</sup> ergibt. | |
| − | Wenn die Konzentration | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | == Das Ionenprodukt == | ||
| + | Die Wasserkonzentration in einer verdünnten Lösung beträgt immer 55,55 mol/L. Daher lässt sich die Gleichung des Massenwirkungsgesetzes umformen: | ||
| + | K = (H<sub>2</sub>O)<sup>2</sup> = K<sub>w</sub> = ''c''(H<sub>3</sub>O<sup>+</sup>) <b>·</b> ''c''(OH<sup>-</sup>) = 10<sup>-14</sup>mol<sup>2</sup> <b>·</b> L<sup>-2</sup> | ||
| − | + | Diese Gleichung dient zur Berechnung des Ionenproduktes, welches konstant bleibt und daher 10<sup>-14</sup> ergeben muss, da die Konzentration der Hydroxid-[[Ionen]] und Oxonium-[[Ionen]] jeweils 10<sup>-7</sup> mol/L ergeben muss. | |
| + | == Der pH-Wert, der pOH-Wert und der pK<sub>w</sub>-Wert == | ||
| − | Anhand der Hydroxid-Ionen und der | + | Anhand der Hydroxid-[[Ionen]] und der Oxonium-[[Ionen]] lässt sich auch der [[pH-Wert]], der [[pOH-Wert]] und der pK<sub>w</sub>-Wert durch folgende Formeln ermitteln: |
[[Bild:PH texstring.png ]] | [[Bild:PH texstring.png ]] | ||
| − | [[Bild: | + | [[Bild:POH_texstring.png ]] |
[[Bild:PKw texstring.png]] | [[Bild:PKw texstring.png]] | ||
| − | Der pH-Wert wird | + | Der pH-Wert wird also aus der Konzentration der Oxonium-[[Ionen]] bestimmt, während man den pOH-Wert über die Hydroxid-[[Ionen]] ermittelt. Der pKw-Wert ist die Summe des pH-Wertes und des pOH-Wertes. |
| − | |||
| − | |||
| + | Bei einem Temperaturunterschied verändert sich das Ionenprodukt K<sub>w</sub> sowie die Gleichgewichtskonstante K. | ||
| + | == Aufgabe zur Berechnung der Konzentration der Oxonium- und Hydroxid-Ionen == | ||
| − | + | Eine verdünnte Säure-Lösung besitzt den pH-Wert 3,2. Wie groß sind die Konzentrationen der Oxonium-Ionen und der Hydroxid-Ionen? | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
gegeben: pH-Wert: 3,2 | gegeben: pH-Wert: 3,2 | ||
| − | gesucht: c(H<sub>3</sub>O<sup>+</sup>) und c(OH<sup>-</sup>) | + | gesucht: ''c''(H<sub>3</sub>O<sup>+</sup>) und ''c''(OH<sup>-</sup>) |
| − | |||
| − | |||
| − | |||
| + | Rechnung: uns ist bekannt-> pH-Wert: 3,2 (einsetzen in die Formel) 3,2 + pOH =14 ---> pOH = 10,8 | ||
| + | Lösung: | ||
| − | + | Konzentration der Oxonium-Ionen: 10<sup>-3,2</sup> da [[Bild:PH texstring.png ]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | Konzentration der Hydroxid-Ionen: 10<sup>-10,8</sup> da [[Bild:POH_texstring.png ]] | ||
| + | {{cb|147|110|202}} | ||
| + | {{www}} | ||
| + | *http://chimge.unil.ch/De/ph/1ph4.htm | ||
| + | *http://www.chemieseite.de/anorganisch/node28.php | ||
| + | *http://www.u-helmich.de/che/12/01-sb/0102/ | ||
| + | *http://www.mhttp://www.chemie-master.de/index.html? | ||
| + | *http://www.chemie-master.de/lex/begriffe/a19.htmluenster.org/uiw/fach/chemie/lexikon/inhalt/autoprotolyse.htm | ||
| + | *http://www.vs-c.de/vsengine/vlu/vsc/de/ch/11/aac/vorlesung/kap_10/vlu/autoprotolyse.vlu/Page/vsc/de/ch/11/aac/vorlesung/kap_10/kap10_2/kap10_2a.vscml.html | ||
| − | + | [[Benutzer:Trinity3000|Trinity3000]] & [[Benutzer:Runzel|Runzel]] | |
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
Aktuelle Version vom 26. Februar 2016, 23:23 Uhr
| Autoprotolyse | ||
|---|---|---|
| vernetzte Artikel | ||
| Säure-Base-Reaktionen | Brönsted-Theorie | |
Inhaltsverzeichnis
Was versteht man unter Autoprotolyse?
Bestimmte Stoffe, die sowohl als Säure als auch als Base reagieren können nennt man Ampholyte. Einige dieser Stoffe reagieren auch als Säure und als Base mit sich selbst - sie protolysieren. Das bekannteste Beispiel hierfür ist das Wasser.
Wenn eine Flüssigkeit eine elektrische Leitfähigkeit besitzt, so müssen in dieser Flüssigkeit Ionen (Atome die eine Ladung besitzen) vorliegen, durch deren Wanderung der Stromtransport stattfinden kann.
Wirklich reines Wasser gibt es nicht. Selbst mehrfach destilliertes Wasser enthält immer noch Fremdteilchen, z. B. aus der Glaswand des Destillationskolbens und aus der Luft aufgenommenes CO2. Aber selbst wenn es uns gelingen würde, absolut reines Wasser herzustellen, würden selbst dort Ionen in geringer Konzentration vorliegen.
Diese Ionen entstehen durch Protonenübertragung von einem Wassermolekül zum anderen. Dieser Vorgang wird als Autoprotolyse bezeichnet (von griech. autos = "selbst").
Die chemische Reaktion der Autoprotolyse
Ein Wassermolekül wirkt also als Säure, ein Anderes als Base, d. h. eines von zwei Wassermolekülen gibt dem benachbarten Molekül ein Proton ab, welches von diesem Wassermolekül aufgenommen wird.
Nach diesem ersten Schritt zieht das Proton aufgrund seiner positiven Ladung Wasser-Moleküle an und es entsteht das Oxonium-Ion (H3O+, veraltet auch als Hydronium oder Hydroxonium-Ion bezeichnet), welches aufgrund seiner Ladung das ebenfalls neu gebildete Hydroxid-Ion (OH-) anzieht.
Das Massenwirkungsgesetz
Für Wasser gilt: Die Konzentration c der Oxonium- und Hydroxidionen liegt bei 25°C bei je 10-7mol/L.
Das Gleichgewicht dieser Reaktion liegt daher stark auf der linken Seite der Reaktion.
Auf das Protolysegleichgewicht lässt sich das Massenwirkungsgesetz anwenden:
Ein Mol hat die Masse von 18 g und ein Liter Wasser besitzt bei 25°C die Masse von 997 g. Daraus folgt, dass ein Liter Wasser 55,4 mol Wasser-Moleküle enthält. Die Wassermolekül-Konzentration beträgt also 55,4 mol/L. Die Konzentration der Hydroxid- und Oxoniumionen beträgt jeweils 10-7mol/L.
Wir setzen diese Werte nun in das Massenwirkungsgesetz ein (Erinnerung: die Konzentrationen der Ausgangsstoffe unter den Bruchstrich und die Konzentration der Produkte über dem Bruchstrich).
Das Produkt der Oxonium-Ionen und der Hydroxid-Ionen muss immer gleich sein.
Wenn die Konzentration der Hydroxid-Ionen z.B. von 10-7 auf 10-4 erhöht wird, so nimmt auch automatisch die Konzentration der Hydroxid-Ionen von 10-7 auf 10-10 ab, da das Produkt beider Konzentrationen immer konstant 10-14 ergibt.
Das Ionenprodukt
Die Wasserkonzentration in einer verdünnten Lösung beträgt immer 55,55 mol/L. Daher lässt sich die Gleichung des Massenwirkungsgesetzes umformen:
K = (H2O)2 = Kw = c(H3O+) · c(OH-) = 10-14mol2 · L-2
Diese Gleichung dient zur Berechnung des Ionenproduktes, welches konstant bleibt und daher 10-14 ergeben muss, da die Konzentration der Hydroxid-Ionen und Oxonium-Ionen jeweils 10-7 mol/L ergeben muss.
Der pH-Wert, der pOH-Wert und der pKw-Wert
Anhand der Hydroxid-Ionen und der Oxonium-Ionen lässt sich auch der pH-Wert, der pOH-Wert und der pKw-Wert durch folgende Formeln ermitteln:
Der pH-Wert wird also aus der Konzentration der Oxonium-Ionen bestimmt, während man den pOH-Wert über die Hydroxid-Ionen ermittelt. Der pKw-Wert ist die Summe des pH-Wertes und des pOH-Wertes.
Bei einem Temperaturunterschied verändert sich das Ionenprodukt Kw sowie die Gleichgewichtskonstante K.
Aufgabe zur Berechnung der Konzentration der Oxonium- und Hydroxid-Ionen
Eine verdünnte Säure-Lösung besitzt den pH-Wert 3,2. Wie groß sind die Konzentrationen der Oxonium-Ionen und der Hydroxid-Ionen?
gegeben: pH-Wert: 3,2
gesucht: c(H3O+) und c(OH-)
Rechnung: uns ist bekannt-> pH-Wert: 3,2 (einsetzen in die Formel) 3,2 + pOH =14 ---> pOH = 10,8
Lösung:
Konzentration der Oxonium-Ionen: 10-3,2 da ![]()
Konzentration der Hydroxid-Ionen: 10-10,8 da ![]()
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Autoprotolyse: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Weblinks
- Autoprotolyse als Google-Suchbegriff
- Autoprotolyse in der Wikipedia
- Autoprotolyse hier in bs-wiki.de mit Google
- Autoprotolyse als Youtube-Video
- http://chimge.unil.ch/De/ph/1ph4.htm
- http://www.chemieseite.de/anorganisch/node28.php
- http://www.u-helmich.de/che/12/01-sb/0102/
- http://www.mhttp://www.chemie-master.de/index.html?
- http://www.chemie-master.de/lex/begriffe/a19.htmluenster.org/uiw/fach/chemie/lexikon/inhalt/autoprotolyse.htm
- http://www.vs-c.de/vsengine/vlu/vsc/de/ch/11/aac/vorlesung/kap_10/vlu/autoprotolyse.vlu/Page/vsc/de/ch/11/aac/vorlesung/kap_10/kap10_2/kap10_2a.vscml.html