Molare Masse
| Molare Masse | ||
|---|---|---|
| vernetzte Artikel | ||
| Stöchiometrie | Atommasse | |
Die molare Masse M (Einheit: g/mol) ist eine für stöchiometrische Berechnungen benötigte stoffspezifische Größe, die sich
- über die Atommassen aus der Summenformel einer chemischen Substanz ableiten lässt
- aus dem Verhältnis einer Masse m zur Stoffmenge n errechnen lässt:
M = m / n - experimentell bestimmen lässt (s.u.)
Experimentelle Ermittlung der molaren Masse eines Gases
Von Janne-Claas K.; WG11B:
Geräte: Gaswägekugel (1 L), Messzylinder (100 mL), Waage, Schlauch
Chemikalien: Nachfüllpatrone mit Feuerzeuggas (F+)
Durchführung:
- Verschließe die Gaswägekugel und bestimme die Masse der mit Luft gefüllten Kugel.
- Lasse das Feuerzeuggas so lange einströmen, bis alle Luft verdrängt ist.
- Verschließe die Kugel wieder, wiege erneut und berechne die Massendifferenz.
- Befülle die Gaswägekugel mit Wasser und bestimme mit Messzylinder das genaue Füllvolumen.
Auswertungsbeispiel: Für ein gasförmiges Alkan ergab sich eine Massendifferenz von +0,6 g. Ein Liter Luft hat bei Raumtemperatur die Masse 1,2 g. Ein Liter des Gases hat daher die Masse 1,8 g. Bei Raumtemperatur beträgt das molare Volumen etwa 24 L/mol.
n(Gas) = V(Gas)/Vm = 1 L · mol / 24 L = 0,0417 mol
M(Gas) = m(Gas)/n(Gas) = 1,8 g / 0,0417 mol = 43,2 g/mol
Aufgabe: Um welches Alkan könnte es sich handeln?
geg: M(CnH2n+2) = 43,2g/mol
ges: n (als Index der Summenformel)
| n | M in g/mol | Alkan |
|---|---|---|
| 1 | 16 | CH4 |
| 2 | 30 | C2H6 |
| 3 | 44 | C3H8 |
Antwort: Es muss sich bei dem Alkan um Propan handeln (C3H8), dies kann man ebenfalls mit der aus den molaren Massen abgeleiteten Formel errechnen: n = (M-2)/14
Übungen
Zusatzaufgabe Nr. 1:
a) Berechne die Dichte von Kohlenstoffmonooxid mit Hilfe der molaren Masse des Stoffes.
geg: M(CO) = 28g/mol; Vmo = 22,4 L/mol
Ges: ρ(CO) (ρ = Dichte)
ρ(CO) = M(CO) · Vmo = (28g · mol)/(22,4mol · L) = 1,25 g/L
Antwort: Kohlenstoffmonooxid hat eine Dichte von 1,25g/L.
b) Vergleiche die Dichte von Kohlenstoffmonooxid mit der Dichte von Stickstoff.
ρ(CO) = 1,25g/L = ρ(N2)
Antwort: Da die molare Masse gleich ist, ist auch die Dichte gleich.
Zusatzaufgabe Nr. 2:
Für eine organische Verbindung wurde die Verhältnisformel C1H1 ermittelt. 800mg der Substanz wurden verdampft. Bei 95°C ergab sich ein Volumen von 300mL. Der Druck war 1013 hPa. Berechne die molare Masse und ermittel die Molekülformel.
geg: C1H1; T0 = 95°C = 368,15K; V = 300mL = 0,3L; p = 1.013hPa; m = 0,8g; R = 83,144 hPa · L · mol-1 · K-1
ges: M(CnHn)
M(C1H1) = 13g/mol
M = 78g/mol
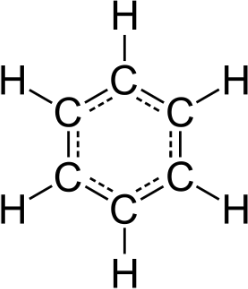
Antwort: Die molare Masse beträgt 78g/mol und die Summenformel ist C6H6 (Benzol).
Von den möglichen Strukturformeln ergibt sich nach Kekulé ein Sechsring:
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Molare Masse: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Experimente und weitere Informationen zum Thema
- {{{1}}} als Google-Suchbegriff
- {{{1}}} in der Wikipedia
- {{{1}}} hier in bs-wiki.de mit Google
- {{{1}}} als Youtube-Video
- Ermittlung der molaren Masse, in: Chemie heute (Ausgabe 1998), Seite 223, Versuch 1-2
- Ermittlung der molaren Masse, in: Elemente Chemie 2, Seite 72, Versuch 1-2
- Ermittlung der molaren Masse: Molare Masse, in: Chemie heute SII, Seite 262, Versuch 1
- Ermittlung der molaren Masse: Molare Masse von Feuerzeuggas, in: Chemie heute SII, Seite 262, Versuch 2
- Ermittlung der molaren Masse: Molare Masse durch Gefriertemperaturerniedrigung, in: Chemie heute SII, Seite 262, Versuch 3
- Molmassenrechner Fa. Merck