Galvanische Zelle: Unterschied zwischen den Versionen
(→Redoxpotentiale) |
Dg (Diskussion | Beiträge) |
||
| (30 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | + | {{navi|Redoxreaktion|Galvanik}} | |
[[Bild:Galvanisches-element.jpg|thumb|300px|Bild einer Galvanischen Zelle]] | [[Bild:Galvanisches-element.jpg|thumb|300px|Bild einer Galvanischen Zelle]] | ||
== Galvanische Zelle == | == Galvanische Zelle == | ||
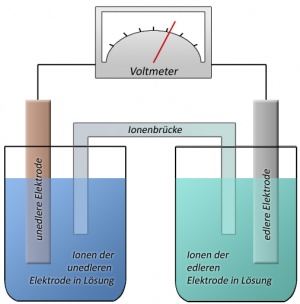
| + | Eine galvanische Zelle oder galvanisches Element ist eine Vorrichtung zur Umwandlung von chemischer in [[elektrische Energie]]. Sie wird in Akkumulatoren verwendet. Die umgangssprachliche Bezeichnung Batterien meint strenggenommen eine Reihung mehrerer Zellen. | ||
| + | Die Funktion der galvanischen Zelle beruht auf einer [[Redox-Reaktion]]. Die [[Reduktion]] läuft räumlich getrennt von der [[Oxidation]] in je einer Halbzelle (Halbelement) ab. Durch Verbinden der beiden Halbzellen mit einem Kabel als Elektronenleiter sowie einem Ionenleiter wird der Stromkreis geschlossen. | ||
| − | |||
| − | |||
Der Name geht auf den italienischen Arzt Luigi Galvani zurück. | Der Name geht auf den italienischen Arzt Luigi Galvani zurück. | ||
| − | Beispiel: | + | |
| − | An der negativen Elektrode, hier die Zinkanode, gehen mehr Zn <sup>2+</sup> -Ionen in Lösung als sich Zn Ionen wieder abscheiden. Da das | + | '''Beispiel:''' |
| − | An der Kupferkathode scheiden sich dagegen mehr Cu <sup>2+</sup> -Ionen an der Elektrode ab als in Lösung gehen. | + | |
| + | [[Kupfer]]elektrode in [[Kupfersulfat]]-Lösung und [[Zink]]elektrode in Zinksulfatlösung. An der negativen Elektrode, hier die Zinkanode, gehen mehr Zn<sup>2+</sup>-Ionen in Lösung als sich Zn-Ionen wieder abscheiden. Da das Zink Elektronen an die Elektrode abgibt, wenn es in Lösung geht, lädt sich die Elektrode negativ auf. | ||
| + | |||
| + | An der Kupferkathode scheiden sich dagegen mehr Cu<sup>2+</sup>-Ionen an der Elektrode ab als in Lösung gehen. Da die Cu<sup>2+</sup>-Ionen zum Abscheiden zwei Elektronen verbrauchen, gibt es an der Kupferelektrode Elektronenmangel, sie lädt sich positiv auf. | ||
| − | Wenn | + | Wenn der positive Pol und der negative Pol elektrisch leitend verbunden werden, fließen Elektronen, also ein elektrischer Strom, von der negativen Elektrode zur positiven Elektrode. Zwischen den beiden Elektrolyten findet der Ladungstransport durch Ionen statt. |
| − | In der Zinksulfatlösung entsteht allerdings ein Überschuss an Zn <sup>2+</sup> -Ionen und die Lösung lädt sich stark positiv auf, sodass nur noch so viele Zinkionen in Lösung gehen wie sich gleichzeitig an der Elektrode wieder abscheiden. Ähnliches passiert mit der Kupfersulfatlösung, nur dass sich hier die Lösung negativ | + | In der Zinksulfatlösung entsteht allerdings ein Überschuss an Zn<sup>2+</sup>-Ionen und die Lösung lädt sich stark positiv auf, sodass nur noch so viele Zinkionen in Lösung gehen wie sich gleichzeitig an der Elektrode wieder abscheiden. Ähnliches passiert mit der Kupfersulfatlösung, nur dass sich hier die Lösung negativ auflädt. |
| − | Kupfersulfatlösung: c[ | + | Kupfersulfatlösung: ''[[Stoffmengenkonzentration|c]]''[SO<sub>4</sub><sup>2-</sup>] >> ''[[Stoffmengenkonzentration|c]]''[Cu<sup>2+</sup>] |
| − | Zinksulfatlösung: c[SO<sub>4</sub><sup>2-</sup>] << c[Zn <sup>2+</sup>] | + | Zinksulfatlösung: ''[[Stoffmengenkonzentration|c]]''[SO<sub>4</sub><sup>2-</sup>] << ''[[Stoffmengenkonzentration|c]]''[Zn<sup>2+</sup>] |
| − | + | Aus diesem Grund werden die Lösungen mit einer Ionenbrücke verbunden. So können die SO<sub>4</sub><sup>2-</sup>-Ionen aus der Kupfer- in die Zinklösung wandern und die Zn<sup>2+</sup>-Ionen aus der Zink- in die Kupfersulfatlösung. Es findet ein Ladungsausgleich zwischen den zwei Lösungen statt und der Strom kann fließen. | |
== Fragen == | == Fragen == | ||
| − | 1) | + | 1) Warum bildet sich bei der Cu/Zn-Zelle ein Überschuss an Ionen? |
| − | 2 | + | 2) Wie erfolgt die Ladungsverteilung beim Aufladen? |
| − | |||
| − | |||
| − | |||
| − | |||
[[Galvanische Zellen: Antworten]] | [[Galvanische Zellen: Antworten]] | ||
[[Bild:redoxpot1.jpg|right]] | [[Bild:redoxpot1.jpg|right]] | ||
| + | |||
== Redoxpotentiale == | == Redoxpotentiale == | ||
| − | Diese Tabelle zeigt die Redoxpotentiale der wichtigsten Metalle sowie von Wasserstoff und Fluor. | + | Diese Tabelle zeigt die Redoxpotentiale der wichtigsten Metalle sowie von [[Wasserstoff]] und [[Fluor]]. |
| − | == Definition Redoxpotentiale == | + | === Definition Redoxpotentiale === |
| − | Redoxpotential | + | Das Redoxpotential ist ein Maß für die Fähigkeit eines Stoffes, Elektronen abzugeben. |
| − | + | * Hohes (negatives) Redoxpotential: der Stoff gibt gerne Elektronen ab. | |
| − | Hohes (negatives) Redoxpotential: der Stoff gibt gerne | + | * Niedriges (positives) Redoxpotential: der Stoff gibt Elektronen gar nicht gerne ab, im Gegenteil, er nimmt lieber Elektronen auf. |
| − | + | === Redoxpotentiale: Übungsaufgaben === | |
| + | * [[Redoxpotentiale: Übungsaufgaben]] | ||
| − | == | + | {{cb|197|139|245}} |
| − | + | == Experimente == | |
| − | + | {{Ex-ec|246|1|Galvanisches Element}} | |
| − | + | {{Ex-ch09|{{fb|187}}|1|Elektrodenpotentiale|Silber/Silberchlorid-Halbzelle}} | |
| − | + | {{Ex-ch09|{{fb|187}}|2|Elektrodenpotentiale|Konzentrationsabhängigkeit}} | |
| + | {{www}} | ||
--[[Benutzer:Franzi g|Franzi g]] 08:16, 14. Jan 2008 (CET) | --[[Benutzer:Franzi g|Franzi g]] 08:16, 14. Jan 2008 (CET) | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
Aktuelle Version vom 15. Februar 2015, 23:25 Uhr
| Galvanische Zelle | ||
|---|---|---|
| vernetzte Artikel | ||
| Redoxreaktion | Galvanik | |
Inhaltsverzeichnis
Galvanische Zelle
Eine galvanische Zelle oder galvanisches Element ist eine Vorrichtung zur Umwandlung von chemischer in elektrische Energie. Sie wird in Akkumulatoren verwendet. Die umgangssprachliche Bezeichnung Batterien meint strenggenommen eine Reihung mehrerer Zellen.
Die Funktion der galvanischen Zelle beruht auf einer Redox-Reaktion. Die Reduktion läuft räumlich getrennt von der Oxidation in je einer Halbzelle (Halbelement) ab. Durch Verbinden der beiden Halbzellen mit einem Kabel als Elektronenleiter sowie einem Ionenleiter wird der Stromkreis geschlossen.
Der Name geht auf den italienischen Arzt Luigi Galvani zurück.
Beispiel:
Kupferelektrode in Kupfersulfat-Lösung und Zinkelektrode in Zinksulfatlösung. An der negativen Elektrode, hier die Zinkanode, gehen mehr Zn2+-Ionen in Lösung als sich Zn-Ionen wieder abscheiden. Da das Zink Elektronen an die Elektrode abgibt, wenn es in Lösung geht, lädt sich die Elektrode negativ auf.
An der Kupferkathode scheiden sich dagegen mehr Cu2+-Ionen an der Elektrode ab als in Lösung gehen. Da die Cu2+-Ionen zum Abscheiden zwei Elektronen verbrauchen, gibt es an der Kupferelektrode Elektronenmangel, sie lädt sich positiv auf.
Wenn der positive Pol und der negative Pol elektrisch leitend verbunden werden, fließen Elektronen, also ein elektrischer Strom, von der negativen Elektrode zur positiven Elektrode. Zwischen den beiden Elektrolyten findet der Ladungstransport durch Ionen statt.
In der Zinksulfatlösung entsteht allerdings ein Überschuss an Zn2+-Ionen und die Lösung lädt sich stark positiv auf, sodass nur noch so viele Zinkionen in Lösung gehen wie sich gleichzeitig an der Elektrode wieder abscheiden. Ähnliches passiert mit der Kupfersulfatlösung, nur dass sich hier die Lösung negativ auflädt.
Kupfersulfatlösung: c[SO42-] >> c[Cu2+]
Zinksulfatlösung: c[SO42-] << c[Zn2+]
Aus diesem Grund werden die Lösungen mit einer Ionenbrücke verbunden. So können die SO42--Ionen aus der Kupfer- in die Zinklösung wandern und die Zn2+-Ionen aus der Zink- in die Kupfersulfatlösung. Es findet ein Ladungsausgleich zwischen den zwei Lösungen statt und der Strom kann fließen.
Fragen
1) Warum bildet sich bei der Cu/Zn-Zelle ein Überschuss an Ionen?
2) Wie erfolgt die Ladungsverteilung beim Aufladen?
Redoxpotentiale
Diese Tabelle zeigt die Redoxpotentiale der wichtigsten Metalle sowie von Wasserstoff und Fluor.
Definition Redoxpotentiale
Das Redoxpotential ist ein Maß für die Fähigkeit eines Stoffes, Elektronen abzugeben.
- Hohes (negatives) Redoxpotential: der Stoff gibt gerne Elektronen ab.
- Niedriges (positives) Redoxpotential: der Stoff gibt Elektronen gar nicht gerne ab, im Gegenteil, er nimmt lieber Elektronen auf.
Redoxpotentiale: Übungsaufgaben
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Galvanische Zelle: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Experimente
- Galvanisches Element, in: Elemente Chemie 2, Seite 246, Versuch 1
- Elektrodenpotentiale: Silber/Silberchlorid-Halbzelle, in: Chemie heute SII, Seite 187, Versuch 1
- Elektrodenpotentiale: Konzentrationsabhängigkeit, in: Chemie heute SII, Seite 187, Versuch 2
Weblinks
- Galvanische Zelle als Google-Suchbegriff
- Galvanische Zelle in der Wikipedia
- Galvanische Zelle hier in bs-wiki.de mit Google
- Galvanische Zelle als Youtube-Video
--Franzi g 08:16, 14. Jan 2008 (CET)