Säurestärke: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) (→Experimentelle Bestimmung von p''K''<sub>S</sub>-Werten) |
Dg (Diskussion | Beiträge) (→Experimentelle Bestimmung von p''K''<sub>S</sub>-Werten) |
||
| Zeile 21: | Zeile 21: | ||
== Experimentelle Bestimmung von p''K''<sub>S</sub>-Werten == | == Experimentelle Bestimmung von p''K''<sub>S</sub>-Werten == | ||
| − | Die p''K''<sub>s</sub>- | + | Die p''K''<sub>s</sub>-Werte schwacher Säuren lassen sich bei bekannter [[Konzentration]] der Säure auf verschiedenen Wegen experimentell bestimmen. |
=== Bestimmung des Halbäquivalenzpunktes === | === Bestimmung des Halbäquivalenzpunktes === | ||
| − | Der pH-Wert am sog. Halbäquivalenzpunkt ist bei schwachen Säuren gleich dem p''K''<sub>S</sub>-Wert der Säure | + | Der pH-Wert am sog. Halbäquivalenzpunkt ist bei schwachen Säuren gleich dem p''K''<sub>S</sub>-Wert der Säure. Hierzu gibt man zu der schwachen Säure genau die Hälfte der [[Stoffmenge]] (''[[Stoffmenge|n]] = [[Volumen|V]]{{*}}[[Stoffmengenkonzentration|c]]'') an starker Base (z. B. Natronlauge), die man für die Neutralisation einer starken Säure (wie Salzsäure) benötigt hätte. |
| − | Gibt man | + | Beispiel: Gibt man zu 100 mL Essigsäure (''c'' = 1 mol/L) 50 mL Natronlauge (''c'' = 1 mol/L) hinzu, stellt sich ein pH-Wert von 4,8 ein, der dem p''K''<sub>s</sub>-Wert entspricht. |
| + | |||
| + | <!--Alternativ kann der p''K''<sub>S</sub> mittels [[Säure-Base-Titration]] aus der der '''pH-Wert am Halbäquivalenzpunkt''' und so der p''K''<sub>S</sub> bestimmt werden.--> | ||
=== Messung des pH-Wertes und Errechnen des p''K''<sub>S</sub>-Wertes === | === Messung des pH-Wertes und Errechnen des p''K''<sub>S</sub>-Wertes === | ||
Version vom 10. März 2012, 22:38 Uhr
| Säurestärke | ||
|---|---|---|
| vernetzte Artikel | ||
| Säure-Base-Reaktionen | pH-Wert-Berechnung | |
Vergleicht man verschiedene Säuren gleicher Konzentration (z. B. Salzsäure mit Essigsäure), ergeben sich unterschiedliche pH-Werte (s. Experiment). Diese Beobachtung lässt sich über die Säurestärke erklären:
Inhaltsverzeichnis
Allgemeines
Die Säurestärke oder Acidität gibt an, in welchem Umfang eine Säure in Wasser protolysiert, d. h. die in der Säure enthaltenen H+-Ionen tatsächlich abgespalten werden.
- Starke Säuren wie Salzsäure protolysieren im Wasser vollständig.
- Schwache Säuren wie Essigsäure hingegen protolysieren im Wasser nur zum Teil, der pH-Wert ist höher (= weniger sauer), als sich nach Konzentration der Säure erwarten lässt.
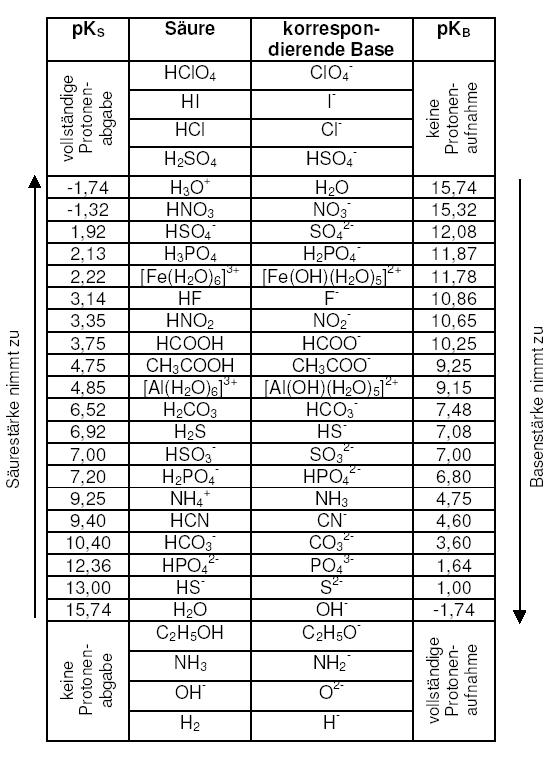
pKS-Werte
Der pKS-Wert ist ein Maß für die Säurestärke. Je niedriger der pKS-Wert, desto stärker (protolysiert) ist die Säure, siehe Tabelle. Im allgemeinen gilt eine Säure mit einem pKS-Wert größer 4 als schwache Säure.
Der pKS-Wert ist der pH-Wert, bei dem 50 % der Säure dissoziiert ist, d. h. die Hälfte aller in der Säure enthaltenen H+-Ionen frei in wässriger Lösung vorliegen.
Als Formel: pKS = 2 · pH + lg c(HA) bzw. pH = 0,5 · (pKS - lg c(HA))
Der pKS-Wert leitet sich als negativer dekadischer Logarithmus (vgl. pH-Wert) von der Säurekonstanten KS ab: pKS = -lg KS.
Anhand dieses mathematischen Zusammenhanges lässt sich der pKS-Wert experimentell bestimmen (siehe unten). Eine umfassende Zusammenstellung der pKS-Werte als Excel-Tabelle von Franz Kass.
Experimentelle Bestimmung von pKS-Werten
Die pKs-Werte schwacher Säuren lassen sich bei bekannter Konzentration der Säure auf verschiedenen Wegen experimentell bestimmen.
Bestimmung des Halbäquivalenzpunktes
Der pH-Wert am sog. Halbäquivalenzpunkt ist bei schwachen Säuren gleich dem pKS-Wert der Säure. Hierzu gibt man zu der schwachen Säure genau die Hälfte der Stoffmenge (n = V · c) an starker Base (z. B. Natronlauge), die man für die Neutralisation einer starken Säure (wie Salzsäure) benötigt hätte.
Beispiel: Gibt man zu 100 mL Essigsäure (c = 1 mol/L) 50 mL Natronlauge (c = 1 mol/L) hinzu, stellt sich ein pH-Wert von 4,8 ein, der dem pKs-Wert entspricht.
Messung des pH-Wertes und Errechnen des pKS-Wertes
Am Beispiel der Essigsäure soll der pKS-Wert experimentell bestimmt werden:
Ausgangskonzentration der Essigsäure lt. Hersteller: c = 10-2 mol · L-1 ; gemessener pH-Wert = 3,4.
Errechnen des pKS-Wertes:
Geg.: c(Essigsäure) = 10-2 mol · L-1; pH = 3,4.
Ges.: pKS(Essigsäure)
Lösung: pKS = 2 · pH + lg c(HA)
Einsetzen: pKS = 2 · 3,4 + lg 10-2
Ausrechnen: pKS = 6,8 + (-2) = 4,8
Antwort: Der pKS-Wert von Essigsäure beträgt 4,8.
Basenkonstante
Starke Basen protolysieren im Wasser vollständig. Bei schwächeren hingegen stellt sich ein Protolysegleichgewicht ein -> KB. Oft verwendet man auch den pKB- Wert :
B(aq) + H2O <--> HO + OH-
KB= c(HB+) * c(OH-) / c(B) ;pKB = -lg KB
Der pKS-Wert + den pKB-Wert müssen zusammen immer = 14 ergeben.
Mehrprotonige Säuren
Beispiele für mehrprotonige Säuren sind Schwefelsäure (H2SO4) oder Phosphorsäure (H3PO4). Die Moleküle dieser Säuren sind in der Lage, mehr als nur ein Proton abzugeben. Da diese Säuren stufenweise protolysieren (1. Proton weg, dann das 2. usw.), gibt für jede Stufe einen eigenen pKS-Wert.
Beispiel Protolyse der 3-protonigen Phosphorsäure:
1. Schritt (= 1. Protolysestufe): In wässriger Lösung bilden sich zunächst Dihydrogenphosphat-Ionen (H2PO4-):
2. Schritt (= 2. Protolysestufe): Bei höherem pH-Wert bilden sich Hydrogenphosphat-Ionen (HPO42-):
3. Schritt (= 3. Protolysestufe): Bei noch höherem pH-Wert bilden sich Phosphat-Ionen (PO43-):
Dies sind Säuren im Sinne Brönsteds: Ionen, deren Ursprung aus der Protolyse mehrprotoniger Säuren stammen und die selbst noch ein Proton abgeben können. Nun lässt sich auch für sie ein pKS-Wert angeben. Nur Phosphorsäure in der 1. Protolysestufe zum Dihydrogenphosphat-Ion ist mit einem pKS = 2,13 eine relativ starke Säure. Die weiteren Protonen werden nicht mehr so leicht abgespalten. In der 2. und 3. Protolysestufe liegt der pKS-Wert bei 7,2 bzw. 12,63, also wie bei einer schwachen Säure (siehe Tabelle).
Um die pKS-Werte mehrprotoniger Säuren auseinanderzuhalten, werden diese entsprechend ihrer Protolysestufe bezeichnet. Bei der Phosphorsäure also pKS1 = 2,13; pKS2 = 7,2; pKS3 = 12,63.
Experiment
"Haben gleich konzentrierte Säuren wirklich unterschiedliche pH-Werte?"
Geräte: Schutzbrille, 2 Bechergläser (50 mL)
Chemikalien: 2 pH-Stäbchen, je ca. 2 ml Essigsäure und Salzsäure (c = 1 mol/L)
Durchführung:
In das eine Becherglas werden wenige ml von der einen Säure gegeben und in das andere Glas wenige ml von der anderen Säure. Nun wird mit Hilfe der pH-Stäbchen getestet, ob diese gleichkonzentrierten Säuren wirklich unterschiedliche pH-Werte haben, indem jeweils ein pH-Stäbchen in eine Säure gehalten wird und die jeweiligen pH-Werte abgelesen werden können.
Nun kann die Ausgangsfrage sicher beantwortet werden ...
Übungen
Übungsaufgaben zur pH-Wert-Berechnung unter Berücksichtigung der Säurestärke findest Du hier.
Weblinks
- Säurestärke als Google-Suchbegriff
- Säurestärke in der Wikipedia
- Säurestärke hier in bs-wiki.de mit Google
- Säurestärke als Youtube-Video
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Säurestärke: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
- Eine umfassende Zusammenstellung der pKS- und pKB-Werte als Excel-Tabelle von Franz Kass.
Dieser Artikel wurde verfasst von: --Blume,--Tascha,--Daddy 12:13, 9. Jan 2006 (CET)