Wertigkeit
Elemente streben über eine chemische Reaktion einen energiearmen Zustand der Außenelektronen an, die Edelgaskonfiguration. Diese vollständige Besetzung der Außenschale erreichen sie durch Übertragung von Elektronen gemäß ihrer Wertigkeit.
Die Wertigkeit ist die Anzahl der Elektronen, die ein Atom aufnimmt bzw. abgibt, um eine vollbesetzte Außenschale zu erlangen. Diese Wertigkeit kann man sich im Modell auch als Bindungsarme vorstellen, die Anzahl der Bindungsarme entspricht der Wertigkeit.
Im einfachsten Fall leitet sich die W. eines Elementes daher aus der Nummer der Hauptgruppe und damit aus der Anzahl der Außenelektronen ab:
| Hauptgruppe | 1. (I A) | 2. (II A) | 3. (III A) | 4. (IV A) | 5. (V A) | 6. (VI A) | 7. (VII A) | 8. (VIII A) |
|---|---|---|---|---|---|---|---|---|
| Außenelektronen | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Wertigkeit Bindungsarme |
1 | 2 | 3 | 4 | 3 | 2 | 1 | 0 |
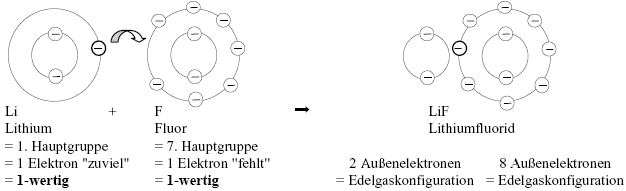
Beispiel:
Anwendung: Summenformeln und Reaktionsgleichungen über Wertigkeiten formulieren
Die Kenntnis der Wertigkeit ist die Voraussetzung zum Aufstellen einer Summenformel und damit von Reaktionsgleichungen, siehe Arbeitsblatt.
Bei identischen Wertigkeiten der Bindungspartner ist die Rohformel (LiF) gleichzeitig die Summenformel.
Unterscheiden sich die Wertigkeiten der Reaktionspartner, erhält man die Indices der Summenformel durch Vertauschen der Wertigkeiten, z. B. reagiert das 3-wertige Aluminium mit dem 2-wertigen Schwefel zu Al2S3.
Vertiefung: Wertigkeit und Oxidationszahlen
Unter der Oxidationszahl (auch: Oxidationsstufe) eines Elements versteht man die Ladung, die ein Atom des Elements hätte, wenn die Elektronen aller von diesem Atom ausgehenden Bindungen dem jeweils stärker elektronegativeren Atom zugeordnet werden. Die Oxidationszahl entspricht also vom Zahlenwert der Wertigkeit aber wird im Unterschied zu dieser mit Vorzeichen (+/-) angegeben.