Radioaktivität
| Radioaktivität | ||
|---|---|---|
| vernetzte Artikel | ||
| Kernenergie | Isotope | |
Inhaltsverzeichnis
Unter Radioaktivität versteht man den natürlichen Zerfall instabiler Isotope in für diese charakteristischen Zeiten, den sogenannten Halbwertszeiten. Alle Isotope ab der Ordnungszahl 84 sind instabil.
Geschichte
Entdeckt wurden die unsichtbaren, energiereichen Strahlen 1896 von Henri Becquerel. Er untersuchte Uranverbindungen auf einen Zusammenhang zwischen Fluoreszenz und Röntgenstrahlung. Dabei entdeckte er, dass Uran eine unsichtbare energiereiche Strahlung aussendet.
In der Folgezeit untersuchten Marie und Pierre Curie ein stärker strahlendes Uranerz, die Uranpechblende. Sie isolierten im Jahr 1898 daraus die Elemente Polonium und Radium. Von Marie Curie stammt auch die Bezeichnung „Radioaktivität“ für energiereiche Strahlung aus Atomen (lat. Radius: der Strahl). Der Energieumsatz beim radioaktiven Zerfall ist um vieles größer als bei chemischen Reaktionen.
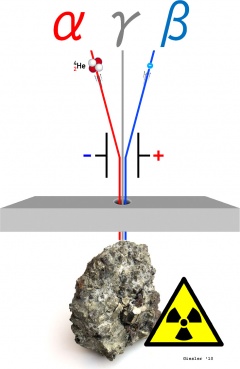
Strahlungsarten
Die Art der emittierten Strahlung bestimmt bei diesem Zerfallsvorgang die Folgeprodukte:
Alpha-Strahlung |
Beta-Strahlung |
Gamma-Strahlung |
|---|---|---|
 Der α-Strahler Ra-226 zerfällt zu Rn-226. |
 Der ß-Strahler Cs-137 zerfällt zu Ba-137. |
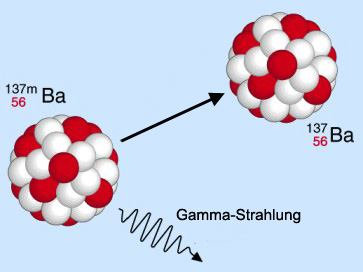 Ein angeregter (metastabiler) Bariumkern sendet Gamma-Strahlung aus. |
| Ein Alpha-Strahler emittiert Heliumkerne (Alphateilchen), somit vermindert sich für das Folgeprodukt die Massenzahl um den Wert vier, die Ordnungszahl um zwei.
Beispiel: Für radioaktive Experimente wird u. a. der α-Strahler Am-241 verwendet. Mit einer Halbwertszeit von 432,2 Jahren zerfällt Am-241 hierbei zu Np-237. |
Beta-Strahlung besteht aus Elektronen, die durch Spaltung eines instabilen Neutrons entstehen. Damit kann für das Isotop des Folgeproduktes sowohl die Massen- als auch die Ordnungszahl errechnet werden. Hierbei gilt: die Massenzahl bleibt konstant, die Ordnungszahl erhöht sich um den Wert eins.
Beispiel: Der radioaktive Beta-Strahler Kohlenstoff C-14 zerfällt in das stabile Isotop N-14 des Elementes Stickstoff. |
Gamma-Strahler: Nach einem α- oder ß-Zerfall befindet sich der neu entstandene Atomkern häufig in einem angeregten, d. h. ernergiereichen Zustand. Wenn der Kern in einen stabilen Energiezustand übergeht, wird diese Energie als Gamma-Strahlung abgegeben. Beispiel: Bestrahlung von Krebszellen mit Co-60. |
Strahlungsmessung
Der „Inspector USB“ (Bild) ist ein Messgerät zum Nachweis radioaktiver Strahlung mittels Geiger-Müller-Zählrohr. Die universelle Auslegung erlaubt Schülern die Messung von Alpha-, Beta-, Gamma- und Röntgenstrahlung.
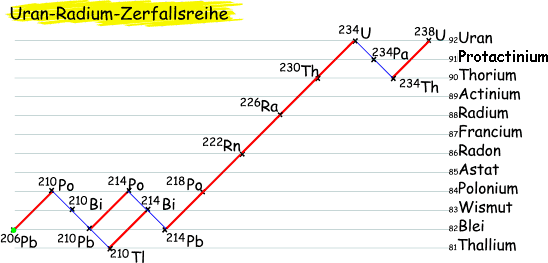
Uran-Radium-Zerfallsreihe
Alle Uranisotope sind radioaktiv und daher instabil. Ihr natürliches Vorkommen ergibt sich aufgrund der radioaktiven Zerfallsreihen. Bei der Uran-Radium-Zerfallsreihe werden Alpha- und Betastrahlen emmitiert, keine Gammastrahlen.
Anwendungsbeispiele
- Altersbestimmung durch die Radiocarbonmethode
- Ernährung: Isotopenanalyse
- Stromerzeugung: Kernenergie
Übungen
Lückentext
Vervollständige folgenden Lückentext zum Thema „Radioaktivität“:
Unter Radioaktivität versteht man den natürlichen - (1) - instabiler Isotope in für diese charakteristischen Zeiten, den sogenannten - (2) - .
Die Art der emittierten Strahlung bestimmt bei diesem Zerfallsvorgang die Folgeprodukte:
- Ein Alpha-Strahler emittiert Heliumkerne, somit vermindert sich für das Folgeprodukt die Massenzahl um den Wert - (3) -, die Ordnungszahl um - (4) -.
- Beta-Strahlung hingegen besteht aus - (5) - , die durch Spaltung eines instabilen - (6) - entstehen. Damit kann für das Isotop des Folgeproduktes sowohl die Massen- als auch die Ordnungszahl errechnet werden.
Hierbei gilt: die - (7) - bleibt konstant, die - (8) - erhöht sich um den Wert - (9) -.
So zerfällt der radioaktive Beta-Strahler Kohlenstoff C-14 in das stabile Isotop - (10) - des Elementes - (11) -.
Arbeitsblatt
Quiz
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Radioaktivität: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Weblinks
- Radioaktivität als Google-Suchbegriff
- Radioaktivität in der Wikipedia
- Radioaktivität hier in bs-wiki.de mit Google
- Radioaktivität als Youtube-Video
- Einführung in das Thema Radioaktivität mit Übungsaufgaben und Versuchsbeschreibungen auf LEIFI, der Schulphysikseite von Ernst Leitner und Uli Finckh
- Selbstlernprogramme zur Radioaktivität mit Übungsaufgaben und Lösungen auf www.kernfragen.de
- Strahlungsarten im Detail bei der Zukunftswerkstatt Jena
- Grundlagen der Kernchemie von Werner Schötschel
- Interessante Informationen über Alpha-, Beta- und Gammastrahlung.