Oxidation: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| Zeile 4: | Zeile 4: | ||
* das {{Mark|Gegenteil zur [[Reduktion]]}}, findet aber zeitgleich statt (siehe [[Redoxreaktion]]) | * das {{Mark|Gegenteil zur [[Reduktion]]}}, findet aber zeitgleich statt (siehe [[Redoxreaktion]]) | ||
* einer vereinfachenden Definition nach eine {{Mark|Reaktion mit [[Sauerstoff]]}}, siehe [[Verbrennung]] | * einer vereinfachenden Definition nach eine {{Mark|Reaktion mit [[Sauerstoff]]}}, siehe [[Verbrennung]] | ||
| + | * die Abspaltung von [[Wasserstoff]] ([[Dehydrierung]]). | ||
* im erweiterten Sinne eine Reaktion, bei der [[Elektron]]en abgegeben werden ('''{{Mark|Elektronen-Abgabe}}'''), z. B. an den [[Sauerstoff]] oder an einen anderen Reaktionspartner mit einer höheren [[Elektronegativität]], zum Beispiel [[Chlor]].<br>[[Magnesium|Mg]] [[Bild:Pfeil.gif]] Mg<sup>2+</sup> + 2[[Elektron|e<sup>-</sup>]], hierbei geht die O. mit einer {{Mark|Erhöhung der [[Oxidationszahl]]}} einher, im Beispiel von 0 auf 2. | * im erweiterten Sinne eine Reaktion, bei der [[Elektron]]en abgegeben werden ('''{{Mark|Elektronen-Abgabe}}'''), z. B. an den [[Sauerstoff]] oder an einen anderen Reaktionspartner mit einer höheren [[Elektronegativität]], zum Beispiel [[Chlor]].<br>[[Magnesium|Mg]] [[Bild:Pfeil.gif]] Mg<sup>2+</sup> + 2[[Elektron|e<sup>-</sup>]], hierbei geht die O. mit einer {{Mark|Erhöhung der [[Oxidationszahl]]}} einher, im Beispiel von 0 auf 2. | ||
Version vom 24. September 2011, 07:52 Uhr
| Oxidation | ||
|---|---|---|
| vernetzte Artikel | ||
| Redoxreaktion | Reaktionstyp | |
Eine Oxidation ist:
- das Gegenteil zur Reduktion, findet aber zeitgleich statt (siehe Redoxreaktion)
- einer vereinfachenden Definition nach eine Reaktion mit Sauerstoff, siehe Verbrennung
- die Abspaltung von Wasserstoff (Dehydrierung).
- im erweiterten Sinne eine Reaktion, bei der Elektronen abgegeben werden (Elektronen-Abgabe), z. B. an den Sauerstoff oder an einen anderen Reaktionspartner mit einer höheren Elektronegativität, zum Beispiel Chlor.
Mg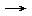 Mg2+ + 2e-, hierbei geht die O. mit einer Erhöhung der Oxidationszahl einher, im Beispiel von 0 auf 2.
Mg2+ + 2e-, hierbei geht die O. mit einer Erhöhung der Oxidationszahl einher, im Beispiel von 0 auf 2.
Der Stoff, der Elektronen aufnimmt (zum Beispiel: Chlor), wird als Oxidationsmittel bzw. Elektronen-Akzeptor ("Nehmer") bezeichnet.
