Radioaktivität: Unterschied zwischen den Versionen
Kati (Diskussion | Beiträge) |
Kati (Diskussion | Beiträge) |
||
| Zeile 62: | Zeile 62: | ||
[[Radioaktivität: Lösung zum Quiz]] | [[Radioaktivität: Lösung zum Quiz]] | ||
| − | {cb|-|20} | + | {{cb|-|20}} |
| − | {www} | + | {{www}} |
* [http://www.educeth.ch/physik/leitprog/radio/docs/radio.pdf ETH Zürich: Leitprogramm Radioaktivität. Ein ausführliches Selbstlernprogramm mit Übungsaufgaben und Lösungen] | * [http://www.educeth.ch/physik/leitprog/radio/docs/radio.pdf ETH Zürich: Leitprogramm Radioaktivität. Ein ausführliches Selbstlernprogramm mit Übungsaufgaben und Lösungen] | ||
Version vom 3. März 2008, 08:07 Uhr
| Radioaktivität | ||
|---|---|---|
| vernetzte Artikel | ||
| Kernenergie | Isotope | |
Unter Radioaktivität versteht man den natürlichen Zerfall instabiler Isotope in für diese charakteristischen Zeiten, den sogenannten Halbwertzeiten. Atome der Elemente ab der Ordnungszahl 84 sind instabil. Die Art der emittierten Strahlung bestimmt bei diesem Zerfallsvorgang die Folgeprodukte:
Inhaltsverzeichnis
Strahlungsarten

Alpha-Strahlung
Ein Alpha-Strahler emittiert Heliumkerne (Alphateilchen), somit vermindert sich für das Folgeprodukt die Massenzahl um den Wert vier, die Ordnungszahl um zwei.
Beta-Strahlung
Beta-Strahlung hingegen besteht aus Elektronen, die durch Spaltung eines instabilen Neutrons entstehen. Damit kann für das Isotop des Folgeproduktes sowohl die Massen- als auch die Ordnungszahl errechnet werden.
Hierbei gilt: die Massenzahl bleibt konstant, die Ordnungszahl erhöht sich um den Wert eins.
So zerfällt der radioaktive Beta-Strahler Kohlenstoff C-14 in das stabile Isotop N-14 des Elementes Stickstoff.
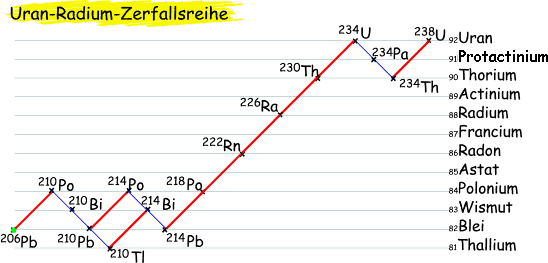
Uran-Radium-Zerfallsreihe
Alle Uranisotope sind radioaktiv und sind daher instabil. Ihr natürliches Vorkommen ergibt sich aufgrund der radioaktiven Zerfallsreihen. Bei der Uran-Radium-Zerfallsreihe werden Alpha- und Betastrahlen emmitiert, keine Gammastrahlen.
Gamma-Strahlung
Geschichte
Entdeckt wurden die unsichtbaren, energiereichen Strahlen 1896 von Henri Becquerel. Er untersuchte Uranverbindungen auf einen Zusammenhang zwischen Fluoreszenz und Röntgenstrahlung. Dabei entdeckte er, dass Uran eine unsichtbare energiereiche Strahlung aussendet. In der Folgezeit untersuchten Marie und Pierre Curie ein stärker strahlendes Uranerz, die Uranpechblende. Sie isolierten im Jahr 1898 daraus die Elemente Polonium und Radium. Sie stellten auch zum ersten Mal klar, dass Radioaktivität kein chemischer Vorgang ist, sondern dass hierbei der Atomkern seinen Charakter ändert. Von Marie Curie stammt auch die Bezeichnung „Radioaktivität“ für energiereiche Strahlung aus Atomen (lat. Radius: der Strahl). Der Energieumsatz beim radioaktiven Zerfall ist um vieles größer als bei chemischen Reaktionen. Die Energie der radioaktiven Strahlung wird häufig in Elektronenvolt (eV) angegeben: 1 eV ist diejenige kinetische Energie, die ein Teilchen mit der Ladung eines Elektrons (1e) im Vakuum aufnimmt, wenn es eine Spannung von 1 Volt durchläuft.
Übungen
Lückentext
Vervollständige folgenden Lückentext zum Thema „Radioaktivität“:
Unter Radioaktivität versteht man den - (1) - instabiler Isotope in für diese charakteristischen Zeiten, den sogenannten - (2) - .
Die Art der emittierten Strahlung bestimmt bei diesem Zerfallsvorgang die Folgeprodukte:
- Ein Alpha-Strahler emittiert Heliumkerne, somit vermindert sich für das Folgeprodukt die Massenzahl um den Wert - (3) -, die Ordnungszahl um - (4) -.
- Beta-Strahlung hingegen besteht aus - (5) - , die durch Spaltung eines instabilen - (6) -entstehen. Damit kann für das Isotop des Folgeproduktes sowohl die Massen- als auch die Ordnungszahl errechnet werden.
Hierbei gilt: die - (7) - bleibt konstant, die - (8) - erhöht sich um den Wert - (9) -.
So zerfällt der radioaktive Beta-Strahler Kohlenstoff C-14 in das stabile Isotop - (10) - des Elementes - (11) -.
Quiz
Radioaktivität: Lösung zum Quiz
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Radioaktivität: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Weblinks
- Radioaktivität als Google-Suchbegriff
- Radioaktivität in der Wikipedia
- Radioaktivität hier in bs-wiki.de mit Google
- Radioaktivität als Youtube-Video
- ETH Zürich: Leitprogramm Radioaktivität. Ein ausführliches Selbstlernprogramm mit Übungsaufgaben und Lösungen
- http://www.akgym.asn-graz.ac.at/radioaktivitaet/index.htm
- Strahlungsarten im Detail
- Inst. für Bodenkunde Uni Hmb.
- Projekt zur Radioaktivität
- Grundlagen der Kernchemie von Werner Schötschel
--Kati 08:41, 28. Jan 2008 (CET)