Halbtitration: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| (11 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | {{navi|Säure-Base-Titration| | + | {{navi|Säure-Base-Titration|Säurestärke}} |
| + | __TOC__ | ||
| + | [[Bild:Halbtitration.jpg|right]] | ||
== Zweck == | == Zweck == | ||
| − | Das Ziel einer '''Halbtitration''' ist die Bestimmung ... | + | Das Ziel einer '''Halbtitration''' ist die [[Experiment|experiment]]elle Bestimmung der [[Säurestärke]] einer schwachen Säure. |
| + | == Laborpraxis == | ||
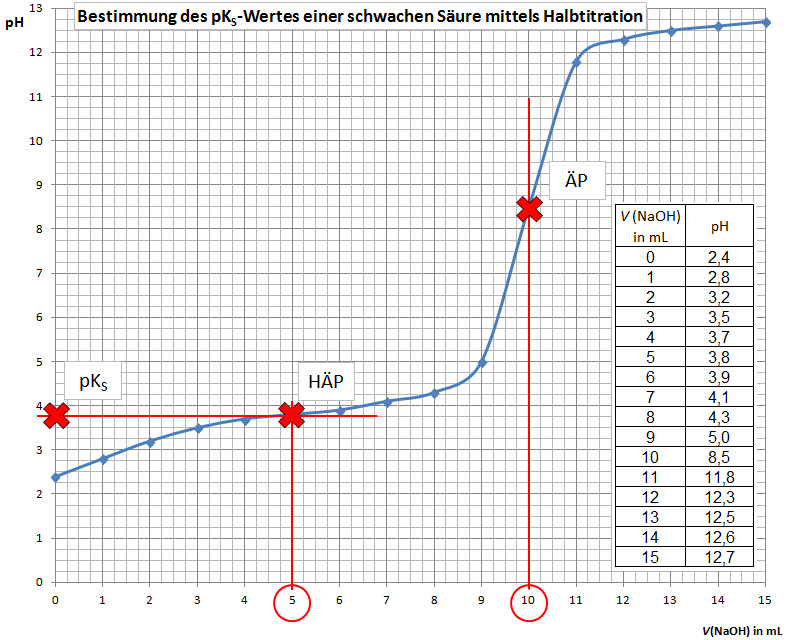
| + | Hierbei wird die schwache Säure mit Natronlauge titriert. Aus der Messreihe (''V''(NaOH)/pH-Werte) wird eine [[Titrationskurve]] erstellt. Mit dieser Titrationskurve kann der pK<sub>S</sub>-Wert der schwachen Säure bestimmt werden: | ||
| + | # Lot fällen vom [[Äquivalenzpunkt]] (ÄP, Wendepunkt der Titrationskurve) | ||
| + | # ''V''(NaOH) beim ÄP ablesen | ||
| + | # Halbäquivalenzpunkt (HÄP) einzeichnen: Senkrechte einzeichnen bei der Hälfte des NaOH-Verbrauches, der Schnittpunkt mit der Titrationskurve ist der Halbäquivalenzpunkt | ||
| + | # pK<sub>S</sub>-Wert ablesen: Der pK<sub>S</sub>-Wert entspricht dem pH-Wert am Halbäquivalenzpunkt. | ||
== Experimente == | == Experimente == | ||
| − | {{Ex-ec|219|1|Bestimmung des pK<sub>S</sub>-Wertes von Salicylsäure mittels Halbtitration}} | + | {{Ex-ec|219|1|Bestimmung des pK<sub>S</sub>-Wertes von [[Salicylsäure]] mittels Halbtitration}} |
| − | {{ | + | * Bestimmung des pK<sub>S</sub>-Wertes von [[Ameisensäure]] mittels Halbtitration gemäß Übungsaufgabe: 50 mL Ameisensäure in 5mL-Schritten mit NaOH bis ca. pH = 12 bzw. 80 mL NaOH titrieren. |
| − | + | ||
| + | == Übungsaufgaben == | ||
| + | {{Ue-ec|219|1|Bestimmung des pK<sub>S</sub>-Wertes von [[Ameisensäure]] mittels Halbtitration}} | ||
| + | |||
{{www}} | {{www}} | ||
| + | {{cb|-|-|219}} | ||
| + | * [[Media:Ameisen-pKs-2.xlsx|Titrationskurve]] von [[Ameisensäure]] als [[Excel]]-Tabellenblatt | ||
[[Kategorie:Chemie]][[Kategorie:Methoden]][[Kategorie:Experiment]] | [[Kategorie:Chemie]][[Kategorie:Methoden]][[Kategorie:Experiment]] | ||
Aktuelle Version vom 12. April 2018, 09:55 Uhr
| Halbtitration | ||
|---|---|---|
| vernetzte Artikel | ||
| Säure-Base-Titration | Säurestärke | |
Inhaltsverzeichnis
Zweck
Das Ziel einer Halbtitration ist die experimentelle Bestimmung der Säurestärke einer schwachen Säure.
Laborpraxis
Hierbei wird die schwache Säure mit Natronlauge titriert. Aus der Messreihe (V(NaOH)/pH-Werte) wird eine Titrationskurve erstellt. Mit dieser Titrationskurve kann der pKS-Wert der schwachen Säure bestimmt werden:
- Lot fällen vom Äquivalenzpunkt (ÄP, Wendepunkt der Titrationskurve)
- V(NaOH) beim ÄP ablesen
- Halbäquivalenzpunkt (HÄP) einzeichnen: Senkrechte einzeichnen bei der Hälfte des NaOH-Verbrauches, der Schnittpunkt mit der Titrationskurve ist der Halbäquivalenzpunkt
- pKS-Wert ablesen: Der pKS-Wert entspricht dem pH-Wert am Halbäquivalenzpunkt.
Experimente
- Bestimmung des pKS-Wertes von Salicylsäure mittels Halbtitration, in: Elemente Chemie 2, Seite 219, Versuch 1
- Bestimmung des pKS-Wertes von Ameisensäure mittels Halbtitration gemäß Übungsaufgabe: 50 mL Ameisensäure in 5mL-Schritten mit NaOH bis ca. pH = 12 bzw. 80 mL NaOH titrieren.
Übungsaufgaben
- Elemente Chemie 2, Seite 219, Aufgabe 1: Bestimmung des pKS-Wertes von Ameisensäure mittels Halbtitration
Weblinks
- Halbtitration als Google-Suchbegriff
- Halbtitration in der Wikipedia
- Halbtitration hier in bs-wiki.de mit Google
- Halbtitration als Youtube-Video
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Halbtitration: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
- Titrationskurve von Ameisensäure als Excel-Tabellenblatt