Kathode: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| (10 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | In der [[Chemie]] ist diejenige Elektrode als Kathode definiert, an der | + | {{navi|Anode|Reduktion}} |
| − | eine | + | In der [[Chemie]] ist diejenige Elektrode als Kathode definiert, an der von Teilchen (Atome, Ionen) eine Elektronenaufnahme (also eine [[Reduktion]]) erfolgt. Die Polung ist dabei von der Betriebsart abhängig: |
| − | dabei von der Betriebsart abhängig: | + | * Bei der [[Elektrolyse]] entspricht die Kathode dem [[Minuspol]], diese zieht aus der Lösung entgegengesetzt, also positiv geladene Teilchen an, z.B. Metall-Kationen. Aufgrund des Elektronenüberschusses in der Elektrode zwingt diese das Metallion zur Elektronenaufnahme, wodurch es sich als elementares Metall an der Elektrodenoberfläche abscheidet.<br />Die technische Anwendung dieses Prinzips ist das [[Galvanisieren]], hierbei wird der zu beschichtende Gegenstand als Kathode geschaltet und z. B. in einer Chromsalzlösung verchromt. |
| − | * Bei der [[Elektrolyse]] entspricht die Kathode dem Minuspol. | + | * In galvanischen Elementen wie z. B. der [[Brennstoffzelle]] entspricht die Kathode dem [[Pluspol]]. |
| − | * In galvanischen Elementen wie z. B. der [[Brennstoffzelle]] entspricht die Kathode dem Pluspol. | + | [[Bild:Elektroden.jpg|right]] |
| + | Der Name leitet sich vom griech. ''kathodos'' ab und bedeutet ''abwärts führender Weg'' und geht von der Vorstellung aus, dass die Elektronen durch den ''Elektronendruck'' an der Kathode in die Lösung geleitet werden, siehe Bild. | ||
| + | |||
| + | == Experimente == | ||
| + | {{CK|203|Farbspiele im Kathodenraum}} | ||
| + | * [[Elektrolyse]] | ||
| + | {{www}} | ||
| + | * [http://www.chemieunterricht.de/dc2/tip/07_02.htm Prof. Blume: Anmerkungen zu den Begriffen Anode und Kathode] | ||
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
Aktuelle Version vom 21. Januar 2018, 17:16 Uhr
| Kathode | ||
|---|---|---|
| vernetzte Artikel | ||
| Anode | Reduktion | |
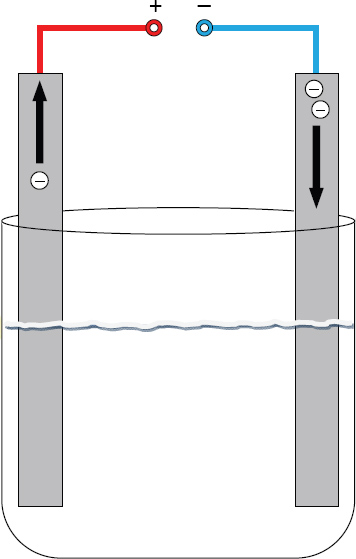
In der Chemie ist diejenige Elektrode als Kathode definiert, an der von Teilchen (Atome, Ionen) eine Elektronenaufnahme (also eine Reduktion) erfolgt. Die Polung ist dabei von der Betriebsart abhängig:
- Bei der Elektrolyse entspricht die Kathode dem Minuspol, diese zieht aus der Lösung entgegengesetzt, also positiv geladene Teilchen an, z.B. Metall-Kationen. Aufgrund des Elektronenüberschusses in der Elektrode zwingt diese das Metallion zur Elektronenaufnahme, wodurch es sich als elementares Metall an der Elektrodenoberfläche abscheidet.
Die technische Anwendung dieses Prinzips ist das Galvanisieren, hierbei wird der zu beschichtende Gegenstand als Kathode geschaltet und z. B. in einer Chromsalzlösung verchromt. - In galvanischen Elementen wie z. B. der Brennstoffzelle entspricht die Kathode dem Pluspol.
Der Name leitet sich vom griech. kathodos ab und bedeutet abwärts führender Weg und geht von der Vorstellung aus, dass die Elektronen durch den Elektronendruck an der Kathode in die Lösung geleitet werden, siehe Bild.
Experimente
- Farbspiele im Kathodenraum, in: Chemische Kabinettstücke, S. 203.
- Elektrolyse