Oxalsäure: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) (Die Seite wurde neu angelegt: „2-Hydroxy-propan-tricarbonsäure, veraltet: Zitronensäure, Summenformel C<sub>6</sub>H<sub>8</sub>O<sub>7</sub> ist eine Carbonsäure. L…“) |
Dg (Diskussion | Beiträge) |
||
| (14 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
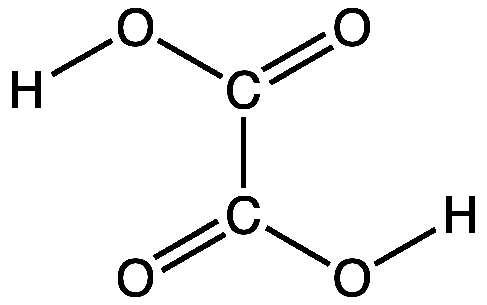
| − | 2 | + | [[Datei:OxalicAcid.png|right]]Kleesäure, Ethandisäure, (COOH)<sub>2</sub>, [[Summenformel]] C<sub>2</sub>H<sub>2</sub>O<sub>4</sub> ist eine [[Carbonsäuren|Carbonsäure]]. Laborüblich als [[Hydrat]] verwendet ({{PAGENAME}}-Dihydrat, C<sub>2</sub>H<sub>2</sub>O<sub>4</sub>{{*}}2 H<sub>2</sub>O). Die [[Salz|Salze]] der {{PAGENAME}} heißen Oxalate. |
| − | {{PAGENAME}} ist eine | + | {{PAGENAME}} ist eine zweiprotonige (Dicarbonsäure), die [[S%C3%A4urest%C3%A4rke#pKS-Werte|pK<sub>S</sub>-Wert]]e betragen: |
| − | * pK<sub>S<sub>1</sub></sub> = | + | * pK<sub>S<sub>1</sub></sub> = 1,2; pK<sub>S<sub>2</sub></sub> = 4,1. |
| − | * [[molare Masse]]n ''M'' = | + | * [[molare Masse]]n ''M'' = 126 g/mol ({{PAGENAME}}-Dihydrat bzw. 90 g/mol (wasserfrei) |
| + | |||
| + | Oxalsäure findet sich z. B. im Sauerklee und Rhabarber und wird u. a. zur Entfernung von Rost- und Tintenflecken verwendet. | ||
{{Sammlung}} | {{Sammlung}} | ||
| + | == Experimente == | ||
| + | Oxalsäure ist ein [[Reduktionsmittel]] und kann daher quantitativ durch [[Redoxtitration]] mit einem [[Oxidationsmittel]] wie [[Kaliumpermanganat]] bestimmt werden. | ||
| + | {{Ex-ec|232|1|Titration einer Oxalsäurelösung}} | ||
| + | {{NiU|120|28 (2010)|Untersuchung des Oxalsäuregehalts von Rhabarber}} | ||
| + | |||
{{www}} | {{www}} | ||
| − | {{UVV| | + | {{UVV|T113}} Oxalsäure-Di[[hydrat]] |
{{Blume|os}} | {{Blume|os}} | ||
[[Kategorie:Chemie]][[Kategorie:Chemikalien]] | [[Kategorie:Chemie]][[Kategorie:Chemikalien]] | ||
[[Kategorie:Ernährungslehre]] | [[Kategorie:Ernährungslehre]] | ||
Aktuelle Version vom 20. Februar 2016, 13:19 Uhr
Kleesäure, Ethandisäure, (COOH)2, Summenformel C2H2O4 ist eine Carbonsäure. Laborüblich als Hydrat verwendet (Oxalsäure-Dihydrat, C2H2O4 · 2 H2O). Die Salze der Oxalsäure heißen Oxalate.Oxalsäure ist eine zweiprotonige (Dicarbonsäure), die pKS-Werte betragen:
- pKS1 = 1,2; pKS2 = 4,1.
- molare Massen M = 126 g/mol (Oxalsäure-Dihydrat bzw. 90 g/mol (wasserfrei)
Oxalsäure findet sich z. B. im Sauerklee und Rhabarber und wird u. a. zur Entfernung von Rost- und Tintenflecken verwendet.
Sicherheitshinweise
Bei der Verwendung von Oxalsäure beim Experimentieren gilt:
| |
Auf Chemikalien-Gefäßen finden sich codierte Hinweise auf Gefährdungen und entsprechende Vorsorgemaßnahmen beim Umgang mit dieser Chemikalie. Diese sogenannten H- & P-Sätze hängen gemeinsam mit den Arbeitsregeln für Schülerexperimente als Betriebsanweisung im Chemieraum aus und müssen in jedem Fall beachtet werden! |
Experimente
Oxalsäure ist ein Reduktionsmittel und kann daher quantitativ durch Redoxtitration mit einem Oxidationsmittel wie Kaliumpermanganat bestimmt werden.
- Titration einer Oxalsäurelösung, in: Elemente Chemie 2, Seite 232, Versuch 1
- Untersuchung des Oxalsäuregehalts von Rhabarber. In: Friedrich Verlag (Hrsg.): Naturwissenschaften im Unterricht Chemie (Zeitschrift), Heft 120, S. 28 (2010).
Weblinks
- Oxalsäure als Google-Suchbegriff
- Oxalsäure in der Wikipedia
- Oxalsäure hier in bs-wiki.de mit Google
- Oxalsäure als Youtube-Video
- Sicherheitsdatenblatt und Produktseite von Oxalsäure unseres Lieferanten Carl Roth Oxalsäure-Dihydrat