Oxalsäure: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| Zeile 2: | Zeile 2: | ||
{{PAGENAME}} ist eine zweiprotonige (Dicarbonsäure), die [[S%C3%A4urest%C3%A4rke#pKS-Werte|pK<sub>S</sub>-Wert]]e betragen: | {{PAGENAME}} ist eine zweiprotonige (Dicarbonsäure), die [[S%C3%A4urest%C3%A4rke#pKS-Werte|pK<sub>S</sub>-Wert]]e betragen: | ||
| − | * pK<sub>S<sub>1</sub></sub> = 1, | + | * pK<sub>S<sub>1</sub></sub> = 1,2; pK<sub>S<sub>2</sub></sub> = 4,1. |
* [[molare Masse]]n ''M'' = 126 g/mol ({{PAGENAME}}-Dihydrat bzw. 90 g/mol (wasserfrei) | * [[molare Masse]]n ''M'' = 126 g/mol ({{PAGENAME}}-Dihydrat bzw. 90 g/mol (wasserfrei) | ||
Version vom 4. Oktober 2015, 15:49 Uhr
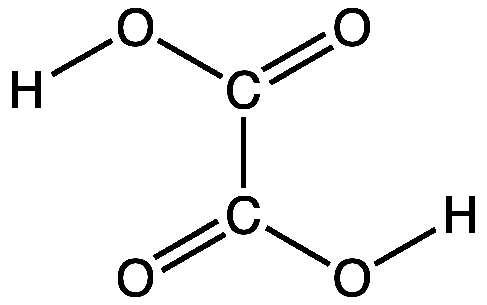
Kleesäure, Ethandisäure, (COOH)2, Summenformel C2H2O4 ist eine Carbonsäure. Laborüblich als Hydrat verwendet (Oxalsäure-Dihydrat, C2H2O4 · 2 H2O). Die Salze der Oxalsäure heißen Oxalate.Oxalsäure ist eine zweiprotonige (Dicarbonsäure), die pKS-Werte betragen:
- pKS1 = 1,2; pKS2 = 4,1.
- molare Massen M = 126 g/mol (Oxalsäure-Dihydrat bzw. 90 g/mol (wasserfrei)
Sicherheitshinweise
Bei der Verwendung von Oxalsäure beim Experimentieren gilt:
| |
Auf Chemikalien-Gefäßen finden sich codierte Hinweise auf Gefährdungen und entsprechende Vorsorgemaßnahmen beim Umgang mit dieser Chemikalie. Diese sogenannten H- & P-Sätze hängen gemeinsam mit den Arbeitsregeln für Schülerexperimente als Betriebsanweisung im Chemieraum aus und müssen in jedem Fall beachtet werden! |
Experimente
Oxalsäure ist ein Reduktionsmittel und kann daher quantitativ durch Titration mit einem Oxidationsmittel wie Kaliumpermanganat bestimmt werden.
- Titration einer Oxalsäurelösung, in: Elemente Chemie 2, Seite 232, Versuch 1
Weblinks
- Oxalsäure als Google-Suchbegriff
- Oxalsäure in der Wikipedia
- Oxalsäure hier in bs-wiki.de mit Google
- Oxalsäure als Youtube-Video
- Sicherheitsdatenblatt und Produktseite von Oxalsäure unseres Lieferanten Carl Roth Oxalsäure-Dihydrat