Natriumacetat: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| Zeile 15: | Zeile 15: | ||
{{Sammlung}} | {{Sammlung}} | ||
{{www}} | {{www}} | ||
| − | {{CAS| | + | {{CAS|10760}} |
[[Kategorie:Chemie]][[Kategorie:Chemikalien]] | [[Kategorie:Chemie]][[Kategorie:Chemikalien]] | ||
Version vom 12. August 2014, 20:32 Uhr
| Natriumacetat | ||
|---|---|---|
| vernetzte Artikel | ||
| Salz | Acetat | |
Natriumacetat (CH3COONa) ist das Na-Salze der Essigsäure, Acetat-Ion: CH3COO¯.
M = 82 g/mol, Dichte = 1,45 g/cm3, Schmelzpunkt = 58 °C.
Als Trihydrat CH3COONa · 3H2O farb- u. geruchlose, bitter-salzig schmeckende Kristalle, spaltet bei 120 °C Kristallwasser ab (Schmp. 324 °C), leicht lösl. in Wasser, mäßig lösl. in Alkohol. In wäss. Lsg. ist das Salz prakt. vollständig dissoziiert mit schwach alkal. Reaktion.
Inhaltsverzeichnis
Verwendung
- Puffersubstanz in essigsauren Lsg.: Enthält eine Lösung gleiche Stoffmengen an Essigsäure und Natriumacetat, so erhält man eine Pufferlösung mit dem pH-Wert 4,65. Beispiel:
Bei der Neutralisation von Essigsäure mit Natronlauge entsteht Natriumacetat und Wasser: CH3COOH + NaOH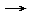 CH3COONa + H2O
CH3COONa + H2O - Füllung von Wärmespeichern (hohe Schmelzenthalpie)
- Lebensmittelzusatzstoff (Konservierungsstoff Natriumdiacetat E 262).
Experimente
- Methan - Darstellung und Eigenschaften, in: Chemie? - Aber sicher!, Seite 14-2 aus Natriumacetat
Sicherheitshinweise
Bei der Verwendung von Natriumacetat beim Experimentieren gilt:
| |
Auf Chemikalien-Gefäßen finden sich codierte Hinweise auf Gefährdungen und entsprechende Vorsorgemaßnahmen beim Umgang mit dieser Chemikalie. Diese sogenannten H- & P-Sätze hängen gemeinsam mit den Arbeitsregeln für Schülerexperimente als Betriebsanweisung im Chemieraum aus und müssen in jedem Fall beachtet werden! |
