Peptidbindung: Unterschied zwischen den Versionen
Joh (Diskussion | Beiträge) (→Struktur der Peptidgruppe) |
Dg (Diskussion | Beiträge) (→Peptidbinung) |
||
| (21 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | [[Bild:lala.jpg]] | + | {{navi|Proteine|Aminosäuren}} |
| − | + | {| | |
| − | + | | __TOC__ || | |
| + | | [[Bild:lala.jpg]] | ||
| + | |} | ||
| − | + | ==Peptide== | |
| − | |||
| + | ''griech.: peptos = verdaulich'' | ||
| + | Bez. für durch Peptid-Bindungen säureamid-artig verknüpfte [[Dehydratisierung|Kondensation]]sprodukte von [[Aminosäuren]]. | ||
| − | == | + | ==Peptidbinung== |
| − | ( | + | Eine Peptidbindung (-NH-CO-) ist eine Bindung zwischen der [[Carboxylgruppe]] einer und der [[Aminogruppe]] einer zweiten Aminosäure. |
| − | |||
| − | + | Zwei [[Aminosäuren]] können (formal) unter [[Dehydratisierung|Wasserabspaltung]] zu einem Dipeptid kondensieren. | |
| − | + | Im Beispiel reagieren zwei Moleküle der einfachsten Aminosäure [[Glycin]] zu einem Dipeptid:[[Bild:Amidbinung.png]] | |
| − | |||
| − | == | + | ==Struktur der Peptidgruppe== |
| − | + | * Bestimmung der Bildungslänge in Peptidbindung durch Röntgenstrukturanalyse | |
| + | * C/N-Bindung ist kürzer als bei [[Amine]]n (Doppelbindungscharakter) | ||
| + | * Peptid-Gruppe ist eben gebaut | ||
| + | * durch die Delokalisierung der Peptidgruppe wird ein besonders stabiles Verbindungsverhältnis erreicht | ||
| + | * [[Carbonyl-Gruppe|Amid-Gruppe]] ist planar gebaut, d. h. alle am Aufbau der der Verbindung beteiligten Atome liegen auf einer Ebene | ||
| + | * der Diederwinkel liegt daher bei 180°[[Bild:Pfeil.gif]]Atome können nicht verdreht werden | ||
| + | * aus Grenzformeln ergibt sich, dass die C/N-Bindung Doppelbindungscharakter hat und so nicht frei drehbar[[Bild:Pfeil.gif]]Atome der Peptidbindung und benachbarte a-C-Atome sind daher in einer Ebene[[Bild:Pfeil.gif]]starre Struktureinheit | ||
| + | * a-C-Atome können zur C/N-Bindung einer Peptid-Gruppe [[cis]] oder [[trans]] angeordnet sein[[Bild:Pfeil.gif]]aus sterischen Gründen meistens [[trans]] | ||
| + | * die Ausbildung einer Peptid-Gruppe beeinflusst die Struktur von [[Proteine]]n | ||
| + | * Verformungen sind nur an den a-C-Bindungen möglich, da diese[[Bild:Pfeil.gif]]tetraedrisch angeordnet und frei drehbar sind | ||
| + | * Möglichkeit der [[Konformation]] ist deshalb bei [[Proteine]]n stark eingeschränkt | ||
| − | + | [[Bild:chemie.jpg]] Grenzformeln | |
| + | [[Bild:chemie2.jpg]]delokalisiertes Elektronensystem | ||
| − | + | ==Aufgabe== | |
| + | [[Glutathion]] ist ein Tripeptid mit der [[Aminosäuren|Aminosäure]]sequenz (Glu-Cys-Gly). Es schützt in lebenden Zellen Verbindungen vor Oxidation. Dabei wird Glutathion selbst oxidiert. M(Glutathion) = 307 g <b>·</b> mol<sup>-1</sup>; M(Oxidationsprodukt) = 612 g <b>·</b> mol<sup>-1</sup>) | ||
| + | a) Gebe die Strukturformel des Tripeptids als [[Zwitterion]] an. Beachte dabei, dass Glutaminsäure im Glutathion eine γ-Peptidbindung ausbildet. | ||
| + | b) Leite die Strukturformel des Oxidationsproduktes aus den Angaben der molaren Massen ab. | ||
| + | c) Gebe die [[Reaktionsgleichung]] der [[Oxidation]] mit Hilfe der Strukturformeln an und benenne den entstehenden Bindungstyp. | ||
| − | + | [[Bild:Pfeil.gif]][[Peptidbindung: Antwort]] | |
| − | + | ==Powerpointpräsentation== | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | http://www.bs-wiki.de/mediawiki/images/Peptidbindung1.ppt | |
| − | |||
| − | |||
| − | + | ==Versuch== | |
| − | + | '''Biuret-Reaktion''' | |
| − | + | Der klassische Nachweis von Proteinen geschieht mit der Biuret-Reaktion. | |
| − | |||
| − | + | '''Chemikalien:''' | |
| − | + | Eiklar-Lösung (Eiklar u. physiologische [[Kochsalz]]-Lösung, diverse Lebensmittel (Fleisch, Nudeln, Kartoffeln, [[Milch]] u.a.), [[Kupfersulfat]]-Lösung, [[Natronlauge]] ca. 4% | |
| − | |||
| − | |||
| − | ''' | + | '''Geräte:''' |
| − | + | Reagenzglas mit Stopfen, [[Reagenzglasständer]], [[Reibschale]] mit Pistill, Tropfpipette, Messpipette 5ml | |
| − | |||
| − | |||
| − | Reagenzglas mit Stopfen,Reagenzglasständer,Reibschale mit Pistill,Tropfpipette,Messpipette 5ml | ||
'''Durchführung:''' | '''Durchführung:''' | ||
| − | In das Reagenzglas gibt man etwa | + | In das Reagenzglas gibt man etwa 2 mL Eiklar-Lösung. Andere Lebensmittel werden in der Reibeschale zerkleinert, mit wenig Wasser aufgeschlämmt und vorsichtig erwärmt, dann werden etwa 2 mL der Lösung in das Reagenzglas dekantiert. Man gibt nun 2 ml [[Natronlauge]] hinzu, verschließt das Glas mit dem Stopfen und schüttelt gut durch. Jetzt werden 3 Tropfen der Kupfersulfat-Lösung zugefügt. |
'''Ergebnis:''' | '''Ergebnis:''' | ||
| − | Bei Anwesenheit von Protein entsteht ein gelber Fleck | + | Bei Anwesenheit von Protein entsteht ein gelber Fleck. |
| + | |||
| + | [[Peptidbindung: Versuchsergebnis|Erklärung]] | ||
| + | |||
| + | |||
| + | {{cb|-|375|351}} | ||
| − | + | {{www}} | |
==Quellen== | ==Quellen== | ||
| − | Chemie heute | + | * Chemie heute, Kapitel 19.8, Seite 375 |
| − | Heinz Schmidkunz, Karin Schlagheck Aulis | + | * Römpp Lexikon Chemie – Version 2.0, Stuttgart/New York: Georg Thieme Verlag 1999 |
| + | * Versuch aus: Unterricht Chemie, Band 11: Lebensmittel-Nährstoffe, Heinz Schmidkunz, Karin Schlagheck, Aulis Verlag Deubner & Co KG | ||
| + | |||
| + | #[[Benutzer:Johannes|Johannes]] | ||
| + | #[[Benutzer:Mille|Mille]] | ||
| + | |||
| + | [[Kategorie:Ernährungslehre]] | ||
| + | [[Kategorie:Chemie]][[Kategorie:Chemikalien]][[Kategorie:Experiment]] | ||
Aktuelle Version vom 2. Oktober 2012, 19:57 Uhr
| Peptidbindung | ||
|---|---|---|
| vernetzte Artikel | ||
| Proteine | Aminosäuren | |

|
Peptide
griech.: peptos = verdaulich
Bez. für durch Peptid-Bindungen säureamid-artig verknüpfte Kondensationsprodukte von Aminosäuren.
Peptidbinung
Eine Peptidbindung (-NH-CO-) ist eine Bindung zwischen der Carboxylgruppe einer und der Aminogruppe einer zweiten Aminosäure.
Zwei Aminosäuren können (formal) unter Wasserabspaltung zu einem Dipeptid kondensieren.
Im Beispiel reagieren zwei Moleküle der einfachsten Aminosäure Glycin zu einem Dipeptid: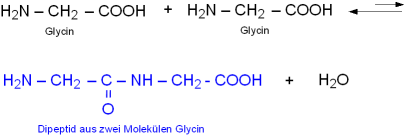
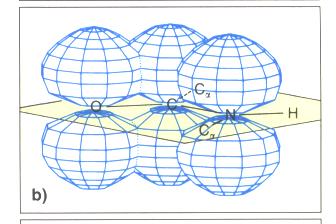
Struktur der Peptidgruppe
- Bestimmung der Bildungslänge in Peptidbindung durch Röntgenstrukturanalyse
- C/N-Bindung ist kürzer als bei Aminen (Doppelbindungscharakter)
- Peptid-Gruppe ist eben gebaut
- durch die Delokalisierung der Peptidgruppe wird ein besonders stabiles Verbindungsverhältnis erreicht
- Amid-Gruppe ist planar gebaut, d. h. alle am Aufbau der der Verbindung beteiligten Atome liegen auf einer Ebene
- der Diederwinkel liegt daher bei 180°
 Atome können nicht verdreht werden
Atome können nicht verdreht werden - aus Grenzformeln ergibt sich, dass die C/N-Bindung Doppelbindungscharakter hat und so nicht frei drehbar
 Atome der Peptidbindung und benachbarte a-C-Atome sind daher in einer Ebene
Atome der Peptidbindung und benachbarte a-C-Atome sind daher in einer Ebene starre Struktureinheit
starre Struktureinheit - a-C-Atome können zur C/N-Bindung einer Peptid-Gruppe cis oder trans angeordnet sein
 aus sterischen Gründen meistens trans
aus sterischen Gründen meistens trans - die Ausbildung einer Peptid-Gruppe beeinflusst die Struktur von Proteinen
- Verformungen sind nur an den a-C-Bindungen möglich, da diese
 tetraedrisch angeordnet und frei drehbar sind
tetraedrisch angeordnet und frei drehbar sind - Möglichkeit der Konformation ist deshalb bei Proteinen stark eingeschränkt
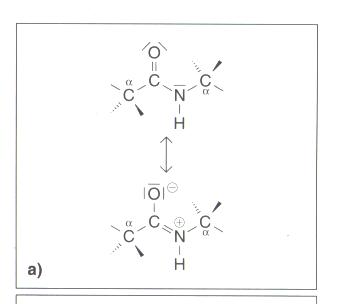 Grenzformeln
Grenzformeln
 delokalisiertes Elektronensystem
delokalisiertes Elektronensystem
Aufgabe
Glutathion ist ein Tripeptid mit der Aminosäuresequenz (Glu-Cys-Gly). Es schützt in lebenden Zellen Verbindungen vor Oxidation. Dabei wird Glutathion selbst oxidiert. M(Glutathion) = 307 g · mol-1; M(Oxidationsprodukt) = 612 g · mol-1)
a) Gebe die Strukturformel des Tripeptids als Zwitterion an. Beachte dabei, dass Glutaminsäure im Glutathion eine γ-Peptidbindung ausbildet.
b) Leite die Strukturformel des Oxidationsproduktes aus den Angaben der molaren Massen ab.
c) Gebe die Reaktionsgleichung der Oxidation mit Hilfe der Strukturformeln an und benenne den entstehenden Bindungstyp.
Powerpointpräsentation
http://www.bs-wiki.de/mediawiki/images/Peptidbindung1.ppt
Versuch
Biuret-Reaktion
Der klassische Nachweis von Proteinen geschieht mit der Biuret-Reaktion.
Chemikalien: Eiklar-Lösung (Eiklar u. physiologische Kochsalz-Lösung, diverse Lebensmittel (Fleisch, Nudeln, Kartoffeln, Milch u.a.), Kupfersulfat-Lösung, Natronlauge ca. 4%
Geräte: Reagenzglas mit Stopfen, Reagenzglasständer, Reibschale mit Pistill, Tropfpipette, Messpipette 5ml
Durchführung: In das Reagenzglas gibt man etwa 2 mL Eiklar-Lösung. Andere Lebensmittel werden in der Reibeschale zerkleinert, mit wenig Wasser aufgeschlämmt und vorsichtig erwärmt, dann werden etwa 2 mL der Lösung in das Reagenzglas dekantiert. Man gibt nun 2 ml Natronlauge hinzu, verschließt das Glas mit dem Stopfen und schüttelt gut durch. Jetzt werden 3 Tropfen der Kupfersulfat-Lösung zugefügt.
Ergebnis: Bei Anwesenheit von Protein entsteht ein gelber Fleck.
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Peptidbindung: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Weblinks
- Peptidbindung als Google-Suchbegriff
- Peptidbindung in der Wikipedia
- Peptidbindung hier in bs-wiki.de mit Google
- Peptidbindung als Youtube-Video
Quellen
- Chemie heute, Kapitel 19.8, Seite 375
- Römpp Lexikon Chemie – Version 2.0, Stuttgart/New York: Georg Thieme Verlag 1999
- Versuch aus: Unterricht Chemie, Band 11: Lebensmittel-Nährstoffe, Heinz Schmidkunz, Karin Schlagheck, Aulis Verlag Deubner & Co KG



