Indikatoren: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) (→Universalindikator-Lösungen) |
Dg (Diskussion | Beiträge) |
||
| Zeile 59: | Zeile 59: | ||
| Yamada || 30 mg [[Bromthymolblau]] || || 6 mg [[Methylrot]] || || 50 mg [[Phenolphthalein]] || 2,5 mg [[Thymolblau]] || | | Yamada || 30 mg [[Bromthymolblau]] || || 6 mg [[Methylrot]] || || 50 mg [[Phenolphthalein]] || 2,5 mg [[Thymolblau]] || | ||
|} | |} | ||
| − | + | {{Ex-ch|415|Mischindikator nach '''Bogen'''|Universalindikator für pH 2-10}} Umschlag bei pH 4 von rot nach orange, bei pH 6 nach gelb, bei pH 8 nach grün, bei pH 10 nach blau | |
* Mischindikator nach '''Cooper''': 100 mg [[Bromkresolgrün]] und 20 mg [[Methylrot]] in 100 ml Ethanol, Umschlag bei pH 4,5 von rot nach blau | * Mischindikator nach '''Cooper''': 100 mg [[Bromkresolgrün]] und 20 mg [[Methylrot]] in 100 ml Ethanol, Umschlag bei pH 4,5 von rot nach blau | ||
Version vom 30. März 2012, 23:11 Uhr
| Indikatoren | ||
|---|---|---|
| vernetzte Artikel | ||
| Säure-Base-Reaktionen | pH-Skala | |
Inhaltsverzeichnis
Was sind Indikatoren?
Das Wort Indikator leitet sich von dem lat. Wort "indicare" ab, was "anzeigen" bedeutet. In der Chemie ist ein Indikator ein Stoff oder ein Gerät, welches zur Überwachung von einer chemischen Reaktion oder eines chemischen Zustandes dient.
Säure/Base-Indikatoren
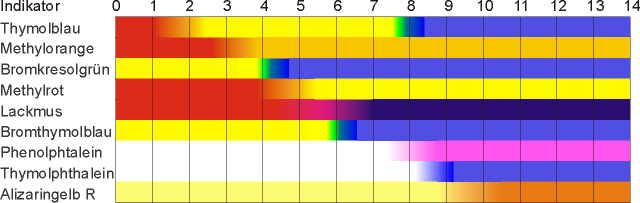
Säure/Base-Indikatoren sind im allgemeinen organische Säuren, welche sich in ihrer Farbe zur korrespondierenden Base unterscheiden.
Bsp.: Gibt man zu dem Indikator Methylorange eine (starke) Säure, ist eine rote Färbung erkennbar. Gibt man eine Base hinzu, färbt sich der Indikator gelb (siehe Bild).
Umschlagsbereiche von Säure/Base-Indikatoren
Die Farbe eines Indikators ergibt sich aus dem Gleichgewicht von Säure zu korrespondierender Base. Ein Farbwechsel ist allerdings erst beim 10-fachen Überschuss einer der Komponenten vollständig auf der pH-Skala sichtbar. Indikatoren können einen bis zwei Umschlagsbereiche besitzen:
pH-Indikatorstäbchen
 |
 |
Die Messung des pH-Wertes durch pH-Indikatorstäbchen ist eine preiswerte Alternative (ca. 10 Cent/Messung) zur professionellen pH-Wert-Messung mittels pH-Meter. Auf einem Träger aus Papier oder Kunststoff sind mehrere verschiedene Indikatoren fixiert, dadurch kann man den pH-Bereich genauer überprüfen als nur mit einem Indikator, der selbst lediglich einen Umschlagspunkt besitzt. |
Messung:
- Der Teststreifen wird in die jeweilige Lösung getaucht und nach einigen Sekunden wieder herausgenommen.
- Anhand des Farbumschlages kann man nun durch Vergleich mit der der Verpackung beigefügten Farbskala den pH-Wert der Flüssigkeit ablesen.
- Der in einer ersten Messung im Bereich von 0 - 14 ermittelte pH-Wert kann in einer Folgemessung mit einem entprechenden pH-Indikatorstäbchen, z.B. für den Bereich 5,1 - 7,2, noch genauer bestimmt werden.
Metallochrome Indikatoren
Experimente
Wirkung von Indikatoren
Damit Du die Wirkung von Indikatoren besser nachvollziehen kannst, haben wir hier einen einfachen Versuch für Dich.
Materialien: 2 Bechergläser, 1 Teelöffel, Schwarzer Tee (zubereitet, jedoch nicht zu stark, evtl. mit Wasser verdünnen), Zitronensaft, Spülmittel (nicht pH-Haut-neutral!)
Durchführung:
- Beide Bechergläser mit schwarzem Tee füllen.
- In das eine B. den Zitronensaft und in das andere Spülmittel hinzugeben und gut umrühren.
Beobachtung?
- Hier kannst du deine Beobachtung kontrollieren.
Universalindikator-Lösungen
- Pufferlösungen pH 1-13 bereitstellen
- Mischung aller Komponenten in 100 ml Alkohol lösen und Farbenspektrum in Abhängigkeit vom pH-Wert notieren:
| Name | Bromthymolblau | Dimethylgelb | Methylrot | Naphtholphthalein | Phenolphthalein | Thymolblau | Thymolphthalein |
| McCrumb | 40 mg Bromthymolblau | 20 mg Methylrot | 20 mg Phenolphthalein | 40 mg Thymolblau | |||
| BDH | 20 mg Bromthymolblau | 20 mg Methylrot | 20 mg Naphtholphthalein | 20 mg Phenolphthalein | 20 mg Thymolphthalein | ||
| Bogen | 80 mg Bromthymolblau | 60 mg Dimethylgelb | 40 mg Methylrot | 20 mg Phenolphthalein | 100 mg Thymolblau | ||
| Kolthoff | 25 mg Bromthymolblau | 19 mg Dimethylgelb | 6 mg Methylrot | 25 mg Phenolphthalein | 25 mg Thymolphthalein | ||
| Yamada | 30 mg Bromthymolblau | 6 mg Methylrot | 50 mg Phenolphthalein | 2,5 mg Thymolblau |
- Universalindikator für pH 2-10, in: Chemie heute (Ausgabe 1998), Seite 415, Versuch Mischindikator nach Bogen Umschlag bei pH 4 von rot nach orange, bei pH 6 nach gelb, bei pH 8 nach grün, bei pH 10 nach blau
- Mischindikator nach Cooper: 100 mg Bromkresolgrün und 20 mg Methylrot in 100 ml Ethanol, Umschlag bei pH 4,5 von rot nach blau
Power Point Präsentation
In dieser Präsentation ist auch noch ein zweiter Versuch zu finden.
Powerpoint-Präsentation zum Thema Indikatoren
Fragen
- In einer Natriumhydrogencarbonat-Lösung zeigt Phenolphthalein eine blassrosa Färbung. Welcher pH-Wert wird dadurch ungefähr angezeigt?
- Was passiert mit Thymolblau, wenn man eine Säure mit dem pH-Wert 1 hinzufügt?
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Indikatoren: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Weblinks
- Indikatoren als Google-Suchbegriff
- Indikatoren in der Wikipedia
- Indikatoren hier in bs-wiki.de mit Google
- Indikatoren als Youtube-Video
- Liste aller an der BBS Winsen vorhandenen Indikatoren
- Versuchsanleitungen der Fa. Conatex zum Thema Indikatoren als PDF-Datei zum Download
- Prof. Rüdiger Blumes umfangreiche Themenseite mit Experimenten und weitergehenden Infos
- Indikatorpuffertablette siehe Eriochromschwarz T