Atommasse: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| Zeile 1: | Zeile 1: | ||
{{navi|Stöchiometrie|atomare Masseneinheit}} | {{navi|Stöchiometrie|atomare Masseneinheit}} | ||
| + | [[Bild:Waage atommasse.jpg|right]] | ||
* Die '''absolute Atommasse''' ''m'' ist die Masse eines [[Atom]]s in der Einheit Gramm oder der [[atomare Masseneinheit |atomaren Masseneinheit]] [[u]].<br>Dabei gilt: 1 [[u]] = 1,6605{{*}}10<sup>-27</sup>kg. Die Werte sind im [[Periodensystem der Elemente (PSE)]] gelistet.<br>Beispiel: Ein [[Eisen]]atom wiegt durchschnittlich 55,845 u bzw. 9,27{{*}}10<sup>-26</sup>kg (0,0000000000000000000000000927 kg), kurz: m(Fe) = 55,845 u = 9,27{{*}}10<sup>-26</sup>kg. | * Die '''absolute Atommasse''' ''m'' ist die Masse eines [[Atom]]s in der Einheit Gramm oder der [[atomare Masseneinheit |atomaren Masseneinheit]] [[u]].<br>Dabei gilt: 1 [[u]] = 1,6605{{*}}10<sup>-27</sup>kg. Die Werte sind im [[Periodensystem der Elemente (PSE)]] gelistet.<br>Beispiel: Ein [[Eisen]]atom wiegt durchschnittlich 55,845 u bzw. 9,27{{*}}10<sup>-26</sup>kg (0,0000000000000000000000000927 kg), kurz: m(Fe) = 55,845 u = 9,27{{*}}10<sup>-26</sup>kg. | ||
Version vom 18. März 2010, 13:52 Uhr
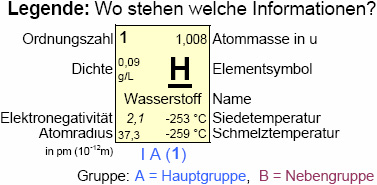
- Die absolute Atommasse m ist die Masse eines Atoms in der Einheit Gramm oder der atomaren Masseneinheit u.
Dabei gilt: 1 u = 1,6605 · 10-27kg. Die Werte sind im Periodensystem der Elemente (PSE) gelistet.
Beispiel: Ein Eisenatom wiegt durchschnittlich 55,845 u bzw. 9,27 · 10-26kg (0,0000000000000000000000000927 kg), kurz: m(Fe) = 55,845 u = 9,27 · 10-26kg.
- Die relative Atommasse Ar ist eine dimensionslose Zahl, die gleich dem Verhältnis der durchschnittlichen Masse je Atom eines Elements zu 1/12 der Masse eines 12C-Isotopes ist, also 1 u. Leichter nachvollziehbar ist die frühere Definition der rel. A., die sich auf das leichteste Atom, also Wasserstoff bezieht: Danach ist die rel. A. ein Vielfaches der Masse eines H-Atoms, neuer und alter Zahlenwert für die rel. A. können vereinfachend gleichgesetzt werden. Alle Werte sind im Periodensystem der Elemente (PSE) gelistet.
Beispiel: Die relative Atommasse von Eisen beträgt 55,845, kurz: Ar(Fe) = 55,845.
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Atommasse: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |