Van-der-Waals-Kräfte: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| Zeile 9: | Zeile 9: | ||
Bei [[Isomerie|Isomeren]] nehmen die Van-der-Waals-Kräfte zwischen den Molekülen mit zunehmender Verzweigung ab, da sich die induzierten Dipole nicht so stark annähern können (="sterische Hinderung"). | Bei [[Isomerie|Isomeren]] nehmen die Van-der-Waals-Kräfte zwischen den Molekülen mit zunehmender Verzweigung ab, da sich die induzierten Dipole nicht so stark annähern können (="sterische Hinderung"). | ||
| + | |||
| + | |||
| + | == Einfluss auf physikalische Eigenschaften wie Schmelz- und Siedepunkt == | ||
| + | Die [[Dipol]]-[[Dipol]]-Wechselwirkung bestimmt die physikalischen Eigenschaften wie Schmelz- und Siedepunkt einer chemischen Verbindung. Mit zunehmenden Van-der-Waals-Kräften steigen auch die Schmelz- und Siedepunkte. | ||
| + | |||
| + | === Übung === | ||
| + | Ordne | ||
{{cb|-|46}} | {{cb|-|46}} | ||
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
Version vom 29. Februar 2008, 09:48 Uhr
| Van-der-Waals-Kräfte | ||
|---|---|---|
| vernetzte Artikel | ||
| Chemische Bindung | Atombindung | |
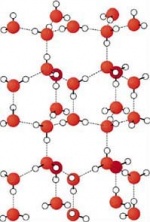
Nach van der Waals benannte zwischenmolekulare Kräfte, die als schwache Bindungskräfte zwischen Molekülen auftreten und im wesentlichen auf die Dipol-Dipol-Wechselwirkung, also elektrostatische Wechselwirkungen zwischen den Molekülen zurückzuführen ist.
Diese Dipol-Dipol-Wechselwirkung ist z. B. zwischen Wassermolekülen sehr stark, da das H2O-Molekül einen starken Dipolcharakter besitzt; man spricht hier von permanenten Dipolen.
Auch zwischen langen Molekülen, z. B. langkettigen Alkanen wirken Van-der-Waals-Kräfte, da es innerhalb dieser langen Moleküle zu temporär ungleichmäßiger Ladungsverteilung kommt, den sog. induzierten Dipolen.
Bei Isomeren nehmen die Van-der-Waals-Kräfte zwischen den Molekülen mit zunehmender Verzweigung ab, da sich die induzierten Dipole nicht so stark annähern können (="sterische Hinderung").
Einfluss auf physikalische Eigenschaften wie Schmelz- und Siedepunkt
Die Dipol-Dipol-Wechselwirkung bestimmt die physikalischen Eigenschaften wie Schmelz- und Siedepunkt einer chemischen Verbindung. Mit zunehmenden Van-der-Waals-Kräften steigen auch die Schmelz- und Siedepunkte.
Übung
Ordne
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Van-der-Waals-Kräfte: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |