Van-der-Waals-Kräfte: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| Zeile 1: | Zeile 1: | ||
{{navi|Chemische Bindung|Atombindung}} | {{navi|Chemische Bindung|Atombindung}} | ||
[[Bild:Wasser Tetraeder.jpg|thumb|150px|H<sub>2</sub>O - ein Molekül mit Dipolcharakter]] | [[Bild:Wasser Tetraeder.jpg|thumb|150px|H<sub>2</sub>O - ein Molekül mit Dipolcharakter]] | ||
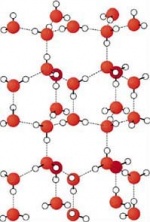
| − | [[Bild:Wasser | + | [[Bild:Wasser Cluster.jpg|thumb|150px|[[Dipol]]-[[Dipol]]-Wechselwirkung zwischen den H<sub>2</sub>O-Molekülen]] |
Nach ''van der Waals'' benannte zwischenmolekulare Kräfte, die als schwache Bindungskräfte zwischen Molekülen auftreten und im wesentlichen auf die '''[[Dipol]]-[[Dipol]]-Wechselwirkung''', also '''[[elektrostatische Wechselwirkung]]en zwischen den Molekülen''' zurückzuführen ist. | Nach ''van der Waals'' benannte zwischenmolekulare Kräfte, die als schwache Bindungskräfte zwischen Molekülen auftreten und im wesentlichen auf die '''[[Dipol]]-[[Dipol]]-Wechselwirkung''', also '''[[elektrostatische Wechselwirkung]]en zwischen den Molekülen''' zurückzuführen ist. | ||
Diese Dipol-Dipol-Wechselwirkung ist z. B. zwischen Wassermolekülen sehr stark, da das H<sub>2</sub>O-Molekül einen starken Dipolcharakter besitzt; man spricht hier von permanenten Dipolen. | Diese Dipol-Dipol-Wechselwirkung ist z. B. zwischen Wassermolekülen sehr stark, da das H<sub>2</sub>O-Molekül einen starken Dipolcharakter besitzt; man spricht hier von permanenten Dipolen. | ||
Version vom 22. Februar 2008, 11:35 Uhr
| Van-der-Waals-Kräfte | ||
|---|---|---|
| vernetzte Artikel | ||
| Chemische Bindung | Atombindung | |
Nach van der Waals benannte zwischenmolekulare Kräfte, die als schwache Bindungskräfte zwischen Molekülen auftreten und im wesentlichen auf die Dipol-Dipol-Wechselwirkung, also elektrostatische Wechselwirkungen zwischen den Molekülen zurückzuführen ist. Diese Dipol-Dipol-Wechselwirkung ist z. B. zwischen Wassermolekülen sehr stark, da das H2O-Molekül einen starken Dipolcharakter besitzt; man spricht hier von permanenten Dipolen.
Auch zwischen langen Molekülen, z. B. langkettigen Alkanen wirken Van-der-Waals-Kräfte, da es innerhalb dieser langen Moleküle zu temporär ungleichmäßiger Ladungsverteilung kommt, den sog. induzierten Dipolen.
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Van-der-Waals-Kräfte: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |