Was sind Ester?
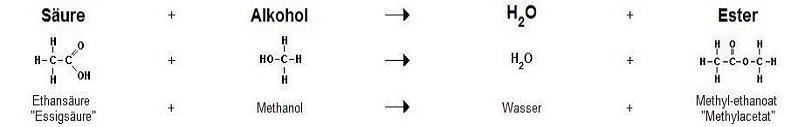
Als Ester bezeichnet man die Stoffgruppe mit der funktionellen COOR-Gruppe (Carbonsäureestergruppe, Alkoxycarbonylgruppe, R = Kohlenwasserstoffrest).
Beispiel: Essigsäureethylester 
Veresterung
Ester entstehen bei der Reaktion von Alkoholen mit Carbonsäuren oder anorganischen Säuren bei gleichzeitiger Abspaltung von Wasser (Kondensationsreaktion, hier: Dehydratisierung).
Esterspaltung
Die Umkehrung (= Rückreaktion) der Veresterung ist die Esterspaltung (= Esterhydrolyse). Da beide Reaktionen gleichzeitig ablaufen, spricht man von einer Gleichgewichtsreaktion.
Eigenschaften
- schlecht wasserlöslich bis hydrophop: Carbonsäureester sind im Bereich der beiden Sauerstoffatome schwach polarisiert. Je länger die unpolaren Kohlenwasserstoffketten werden, desto geringer ist die Wasserlöslichkeit des Estermoleküls. Zum Vergleich: In 1 l Wasser lösen sich 250 g Essigsäuremethylester aber nur noch 80 g Essigsäureethylester. Alle längerkettigen Ester sind also hydrophob.
- Schmelz- u. Siedepunkte liegen im Vergleich zu Alkoholen bzw. Carbonsäuren gleicher Kettenlänge durch nur geringe Ausbildung von Wasserstoffbrücken-Bindungen wesentlich niedriger.
Beispiele
- Die Ester der niederen Fettsäuren (1-7 Kohlenstoffatome) nutzt man auch in der Parfüm- und Duftherstellung. Z. B. zeichnen sich die Ester der übelriechenden Buttersäure durch fruchtartigen Geruch aus.
- Fette
- Sekundenkleber
Übungsaufgaben
- Elemente Chemie 2, Seite 118, Aufgabe A1: Ester
- Elemente Chemie 2, Seite 121, Aufgabe A1: Ester
- Elemente Chemie 2, Seite 124, Aufgabe A8: Essigsäure und 2-Methylpropan-1-ol
- Elemente Chemie 2, Seite 124, Aufgabe A11: Esterspaltung
- Vervollständige: Fruchtester lassen sich synthetisch durch die Reaktion einer Carbonsäure mit einem ________________ herstellen. Da die ________________________ der Veresterung sehr klein ist, wird diese im Allgemeinen durch Zugabe eines _______________________ erhöht, z. B. _______________________ . Die funktionelle Gruppe der Ester ist die ________________-Gruppe.
- a) Zeichne die Strukturformel für eine Komponente des Birnenaromas, den Ethansäurepentylester. b) Formuliere die Reaktionsgleichung (mit Strukturformeln und Stoffbezeichnungen) zur Herstellung dieses Fruchtesters.
- Baue mit dem Molekülbaukasten in Partnerarbeit folgende Ester aus den entsprechenden Säuren und Alkanolen und formuliere die dazugehörigen Reaktionsgleichungen:
- - Methansäureethylester
- - Butansäurepropylester
- - Pentansäuremethylester
Experimente
- Aromastoffe, in: Chemie heute (Ausgabe 1998), Seite 274, Versuch 1
- Essigsäureethylester
- Estergleichgewicht, in: Chemie heute (Ausgabe 1998), Seite 96, Versuch 3
- Estergleichgewicht: Essigsäureethylester-Gleichgewicht, in: Chemie heute SII, Seite 330, Versuch 1
- Untersuchung von Gleichgewichten: Gleichgewichtseinstellung bei der Veresterung, in: Chemie heute SII, Seite 108, Versuch 2
- Veresterung und Esterspaltung, in: Elemente Chemie 2, Seite 118, Versuch 1-5
- Veresterung und Esterspaltung, in: Elemente Chemie 2, Seite 144, Versuch 1
- Veresterung und Esterspaltung, in: Elemente Chemie 2, Seite 146, Versuch 1
- Borsäureester, in: Chemische Kabinettstücke, S. 277.
- Ester als natürliche Duftstoffe, in: Chemische Kabinettstücke, S. 282.
Weblinks
- Ester als Google-Suchbegriff
- Ester in der Wikipedia
- Ester hier in bs-wiki.de mit Google
- Ester als Youtube-Video
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Ester: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
- Versuchsanleitungen der Fa. Conatex zum Thema Ester als PDF-Datei zum Download „Chemie riecht gut.“
- Thomas Seilnacht: Die Herstellung von Aromastoffen
- zwei Varianten zur Herstellung von Essigsäurepentylester (Birnengeruch) aus 1-Pentanol und Essigsäure mittels:
- Schwefelsäure (Urs Wuthier, ETH Zürich)
- wasserfreies Zinkchlorid (Christian Lego, Uni Marburg) - Dr. Horst Klemeyer: Die Ester aus primären n-Alkanolen mit n-Carbonsäuren im Überblick, in: Beispiele und Übungen zur Erstellung von Gefährdungsbeurteilungen, S. 24ff