Elektronegativität
| Elektronegativität | ||
|---|---|---|
| vernetzte Artikel | ||
| Chemische Bindung | elektrostatische Wechselwirkung | |
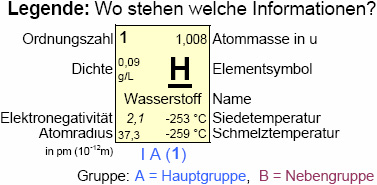
Unter der EN versteht man das Bestreben eines Elementes, die Elektronen innerhalb einer chem. Bindung an sich zu ziehen (spontanes Schülerzitat: "Elektronen-Klaukraft").
Gemäß Linus Pauling wurde dem Element mit der stärksten EN (Fluor) willkürlich der Wert vier zugeschrieben (EN(F) = 4), dem elektroschwächsten Element (Francium) der Wert 0,7.
Die Edelgase besitzen durch ihre voll besetzten Elektronenschalen demnach keine EN.
Im Periodensystem der Elemente (PSE) sind die EN-Werte bei den jeweiligen Elementen aufgeführt.
Anhand der Stellung eines Elementes im PSE lässt sich über den Atombau die EN abschätzen:
- Innerhalb einer Periode steigt mit zunehmender Ordnungszahl die Elektronegativität, da mit zunehmender Protonenzahl im Kern die elektrostatische Wechselwirkung (Anziehungskraft) zu den negativ geladenen Elektronen auf der Außenschale größer wird.
- Innerhalb einer Gruppe sinkt die Elektronegativität mit zunehmender Ordnungszahl, da trotz zunehmender Protonenzahl die Anzahl der Elektronenschalen und damit der Abstand Kern/Außenschale größer und somit die elektrostatische Wechselwirkung schwächer wird.
Bei Elektronegativitätsdifferenz (ΔEN) der Bindungspartner stellt sich eine Ladungsverschiebung bzw. -übertragung in Richtung des elektronegativeren Atoms ein, siehe Chemische Bindung.
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Elektronegativität: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |