Redoxpotentiale: Übungsaufgaben
Aus BS-Wiki: Wissen teilen
Version vom 23. März 2011, 17:44 Uhr von Dg (Diskussion | Beiträge)
Abhängigkeit vom pH-Wert
Eine Lösung enthält Dichromat-Ionen mit c(Cr2O72-) = 0,1 mol/L und Chrom(III)-Ionen mit c(Cr3+) = 0,001 mol/L. Die Lösung wird durch Säurezugabe angesäuert. Berechne das Redoxpotential dieses Redoxpaares bei a) pH = 7; b) pH =1; c) pH = 3.
1. Reaktionsgleichung formulieren und Anzahl z der übertragenen Elektronen ermitteln:
- Cr2O72- + 14 H+ + 6 e-
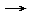 2 Cr3+ + 7 H2O
2 Cr3+ + 7 H2O - z = 6
2. Standard-Elektrodenpotential UH0 des Redoxpaares (Ox/Red) aus Spannungsreihe ermitteln (z. B. Chemie heute, S. 141):
- UH0(Cr2O72-/Cr3+) = 1,33 V
3. Einsetzen der Zahlenwerte in die Nernstsche Gleichung:
- UH(Ox/Red) = UH0(Ox/Red) + (0,059 V/z) · log10 c(Ox)/c(Red)
4. Unter Berücksichtigung des pH-Wertes ergibt sich nach den Regeln des Massenwirkungsgesetzes in saurer Lösung:
- UH(Ox/Red) = 1,33 V + (0,059 V/6) · log10 [c(Cr2O72-) · c(H+)14/c(Cr3+)2]
a) für pH = 7 gilt damit:
- UH(Ox/Red) = 1,33 V + (0,059 V/6) · log10 [0,1 · (10-7)14 / (10-3)2]
Zehnerpotenzen zusammenfassen:
- UH(Ox/Red) = 1,33 V + (0,059 V/6) · log10[10-93]
Zwischenergebnis:
- UH(Ox/Red) = 1,33 V + (0,059 V/6) · (-93)
Ausrechnen:
- UH(Ox/Red) = 0,42 V