Chemolumineszenz
| Chemolumineszenz | ||
|---|---|---|
| vernetzte Artikel | ||
| Luminol | Lumineszenz | |
Chemolumineszenz beschreibt die chemische Reaktion und daraus folgende nicht thermische Lichtabgabe eines Stoffes (Phänomen des kalten Lichtes).
Inhaltsverzeichnis
Definition
Bei der Chemolumineszenz (auch: Chemilumineszenz) werden Elektronen durch eine chemische Reaktion vorübergehend auf ein energetisch höheres Energieniveau gehoben. Beim Zurückfallen in den Grundzustand wird Energie in Form von sichtbarem Licht abgegeben.
Vorkommen
Die Chemolumineszenz lässt sich in vielen Gebieten beobachten, sowohl bei uns Menschen in Medizin, Kriminalistik und Unterhaltung sowie in der freien Natur, tief im Ozean und als leuchtende Glühwürmchen am Himmel.
Natur
In der Natur bezeichnet man die Chemolumineszenz als Biolumineszenz. Als Biolumineszenz bezeichnet man in der Biologie die Fähigkeit von Lebewesen, selbst oder mit Hilfe von Symbionten Licht zu erzeugen. Dieses Phänomen tritt z.B. bei Tiefseetieren in 800-2000 Metern Tiefe auf. Sie leuchten zu Paarungszwecken oder um Beute anzulocken. An Land: Glühwürmchen. Nur die Weibchen leuchten, zur Partnersuche. Das Leuchten wird durch den körpereigenen Stoff Luciferin, welcher mit Sauerstoff oxidiert, gebildet.
Technik
In der Technik findet die Chemolumineszenz Beispielsweise Anwendung in der Kriminalistik. Dort werden Blutspuren durch die Oxidation von Luminol mit Wasserstoffperoxid in Gegenwart von Eisen- oder Mangan-Ionen (im Blutfarbstoff Hämoglobin enthalten) sichtbar gemacht. Weiterhin findet die Chemolumineszenz Anwedung in der Produktion von Knicklichtern.
Chemische Reaktion
Bei der Chemolumineszenz entstehen oft instabile Peroxide, wie 1,2-Dioxetane oder 1,2-Dioxete, die unter Abspaltung von O2 wieder zerfallen.
Die dabei freiwerdende Energie kann entweder bei dem O2-Molekül oder bei dem anderen Reaktionspartner verbleiben. Eines der beiden Bruchstücke der Zerfallsreaktion befindet sich durch den "Energiebesitz" im Zustnad der "Anregung", aus dem es durch Abgabe der Energie in Form eines "Lichtquants" (Lichtteilchens) in den Grundzustand zurückkehren kann.
Demnach beobachtet man das Lumineszenz-Spektrum des einen oder des anderen Partners.
Man unterscheidet je nach Art der Anregung um welche Art von Lumineszenz es sich handelt.
Experiment
Geräte
Stativ, Trichter, Dimrothkühler, s.g. Reaktor, Schläuche, Spatel, Erlenmeyerkolben, Becherglas.
Chemikalien
Luminol (3-Aminophthalhydrazid)
Natronlauge (NaOH)
Kaliumhexacyanoferrat(III)
Wasserstoffperoxidlösung (H2O2) 35%
Sicherheit
Durchführung
2 Lösungen werden hergestellt
Lösung A: 1g Luminol und 50ml 10% NaOH in 450ml destillierten Wasser.
Lösung B: 15g Kaliumhexacyanoferrat (III) in 485ml destilliertem Wasser.
Vorbereitung der Reaktion
Lösung C: 50ml der Lösung A in 350ml destilliertem Wasser.
Lösung D: 50ml der Lösung B in 350ml destilliertem Wasser. Anschließend 10ml 30-35% Wasserstoffperoxid hinzufügen.
Jetzt kann durch gleichzeitiges Vermischen der Lösungen C & D in einem Kolben (o.ä.) eine blau-grüne Chemolumineszenz erzeugt werden. Nach ca. 30 Sek. werklingt das Leuchten der Lösung langsam. Durch erneutes hinzugeben von 10%er NaOH Lösung kann das Leuchten wieder aufgefrischt werden. Zeigt sich bei NaOH keine Reaktion mehr kann noch bis zu 12 Stunden lang durch beigeben von geringen Mengen Kaliumhexacyanoferrat(III) ein Leuchten herbeigeführt werden.
Reaktionsgleichung
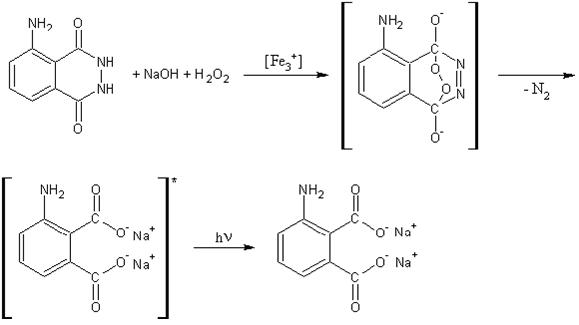
Luminol (3-Aminnophtalsäure-hydrazid) wird durch Wasserstoffperoxid oxidiert, wobei bestimmte Metallionen (z.B. Fe(III) im Hexacyanoferrat) als Katalysator wirken. Als Zwischenstufe tritt ein zyklisches Peroxid auf, bei dessen Zerfall Licht emittiert wird. Die Lösung erwärmt sich nur geringfügig. Die freiwerdende Energie wird überwiegend in Form von Licht abgegeben.
Beobachtung & Auswertung
Aufgabenvorschläge
Notiert was ihr im Laufe des Experiments seht!
Nach dem auffrischen durch NaOH bzw. Kaliumhexycaynoferrat!
Lückentext
Bei diesem Experiment wird Luminol, welches in Natronlauge eingestellt wurde, als Leuchtmittel benutzt. Das Wasserstoffperoxid dient als [ ]. Das Luminol bildet mit dem Wasserstoffperoxid ein zyklisches Peroxid. Das Peroxid zerfällt und Stickstoff wird freigesetzt. Dabei bildet sich mit der Natronlauge das Natriumsalz der 3-Aminophthalsäure (Dicarbonsäure), welches sich im [ ] Zustand befindet. Die dadurch enthaltene Energie wird in Form von [ ] abgegeben. In dieser Zeit [ ] die Lösung! Um die Leuchtkraft zu verstärken, wurde ein Schwermetallkation zugesetzt. In diesem Fall Eisen-III aus [ ]
Arbeitsblatt & Lösung


