Carbonylgruppe
Inhaltsverzeichnis
Definition
Carbonylgruppen sind chemische Gruppen in organischen Verbindungen. Sie bestehen aus einem Kohlenstoff- und einem Sauerstoffatom, die durch eine C=O Doppelbindung verknüpft sind. Die Carbonylgruppe ist die funktionelle Gruppe und gleichzeitig das charakteristische Merkmal für Aldehyde und Ketone.
Die Wichtigsten Carbonylgruppen
| Strukturformel | ||
|---|---|---|
| Aldehyd | 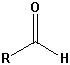 |
|
| Keton | 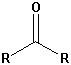 |
|
| Carbonsäure | 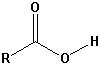 |
|
| Alkanoylhalogenid | Datei:Alkano1.JPG | |
| Anhydrid | Datei:Anhyd1.JPG | |
| Ester | 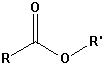 |
|
| Lacton (Cyclische Ester) | Datei:Lacton1.JPG | |
| Amid (Cyclisches Amid = Lactam) |  |
Man kann diese Carbonylverbindungen in zwei Untergruppen einteilen:
1. Aldehyde und Ketone
Aldehyde und Ketone können keine negative Ladung tragen, denn sie besitzen weder ein H-Atom noch eine Alkyl- oder Aryl-Gruppe. Aus diesem Grund können sie auch nicht als Abgabgsgruppe dienen. Aldehyde und Ketone verfügen über ähnliche chemische Eigenschaften wie Carbonsäurederivate, unterscheiden sich aber dennoch von ihnen.
2. Acyl-Rest (RCO) in Carbonsäuren und ihre Derivate
Acyl-Rest (RCO) in Carbonsäuren und ihre Derivate sind elektronegative Heteroatome, sie tragen also eine negative Ladung und können aus diesem Grund als Abgangsgruppe dienen. Die Chemie dieser Carbonylverbindungen ist deshalb untereinander ähnlich, weisen aber dennoch einige Unterschiede in ihren chemischen Eigenschaften auf.
Carbonylverbindungen
Aldehyde und Ketone werden als Carbonylverbindungen bezeichnet, da sie beide die Carbonylgruppe als Strukturelement besitzen. Carbonylverbindungen mit einer endständigen Carbonyl-Gruppe werden als Aldehyde bezeichnet, Verbindungen bei denen die Carbonyl-Gruppe nicht endständig ist heißen Ketone.
Sie sind auch in der Natur zu finden, zum Beispiel spielen 28 verschiedene Carbonylverbindungen und deren Derivate eine große Rolle als Duftstoffe von Erdbeeren, Wein und auch Blumen.
Formaldehyd und seine Verwendung
Formaldehyd (Trivialname von Methanal), welches eine Carbonyl-Gruppe enthält, ist als Reinsubstanz ein farbloses Gas, welches eine Siedetemperatur von -19°C hat. In einigen Langzeitversuchen an Tieren wurde klar, wie gesundheitsschädigend Formaldehyd ist, ob in verarbeiteter oder unverarbeiteter Form.
Genutzt wird Formaldehyd als einer der wichtigsten Grundstoffe der chemischen Industrie und dient ebenfalls als Ausgangsstoff für viele andere chemische Verbindungen. Der größte Teil des hergestellten Formaldehyds wird jedoch zur Herstellung von Kunststoffen wie Aminoplasten und Phenoplasten genutzt.
Außerdem wird es bei der Textilveredelung und bei der Herstellung Farbstoffen und Pharmaka verwandt, sowie als Konservierungsstoff für verderbliche Güter wie Kosmetika.
Die Verwendung von Formaldehyd gestaltet sich jedoch problematisch und ist umstritten, da es hautreizend ist. Es gilt auch als krebserrebgend, da die Formaldehyd-Moleküle bei höheren Konzentrationen in die Zelle oder den Zellkern eindringen können und dort mit den NH2-Gruppen der Nucleinsäure reagieren. Sie können also die Funktionsfähigkeit von Proteinen irreversibel stören. Dadurch können Schäden hervorgerufen werden, die zu krebsartigen Entartungen führen können.
Additionsreaktionen
Da Aldehyde und Ketone ungesättigte Verbindungen sind, sie also die Edelgaskonfiguration anstreben, sind sie sehr reaktionfreudig. Es kommt zu sogenannten Additionsreaktionen, wobei die nucleophile Additon mit Hydronium-Ionen charakteristisch ist. Als Reaktionspartner dienen hierbei Alkohole, Wasser und Anionen.
Die Addition von Alkoholen an Carbonyl-Verbindungen läuft in zwei Schritten ab:
1. Schritt:
Das Sauerstoff-Atom der Carbonylgruppe wird protoniert, d.h. ein Proton wird ihm abgenommen, wodurch es eine negative Ladung bekommt. Mit dem freien Elektronenpaar dieses Sauerstoff-Atoms greift das Alkohol-Molekül nun das Carbonyl-C-Atom nucleophil an. Das Alkohol kann also aufgrund seiner negativen Ladung das positiv geladene Carbonyl-C-Atom agreifen und ihm ein Proton entreißen. Aus einem Aldehyd wird so ein Halbacetal, aus einem Keton bildet sich auf diesem Weg ein Halbketal. Diese Moleküle besitzen die Eigenschaft, dass an einem ihrer C-Atome eine OH- sowie eine Ether-Gruppe sitzt.
2. Schritt:
In diesem Schritt ist es möglich, dass die OH-Gruppe des Halbacetals/Halbketals proteoniert wird, im Anschluss daran wird ein H2O-Molekül eliminiert. Folge: ein Acetal/Ketal entsteht. Ihre Bildung ist häufig durch ihren angenehmen Geruch erkennbar.
Oxidation & Reduktion der Carbonyl-Gruppe
Die Carbonyl-Gruppe von Aldehyden und Ketonen können oxidiert und reduziert werden, je nach ihrer Oxidationszahl. Aldehyde (Oxidationszahl I) zum Beispiel, lassen sich sehr gut oxidieren, bei Ketonen (Oxidationszahl II) funktioniert dies nur, wenn zuvor Bindungen gespaltet wurden. Ketone wiederum lassen sich gut reduzieren, da sie die Oxidationszahl II haben. Auf diesem Wege kann gut experimentell zwischen Aldehyden und Ketonen unterschieden werden. (siehe Versuch)
Oxidation und Reduktion von Carbonyl-Gruppen:
Versuch
Die FEHLING-Probe:
Geeignet für die Durchführung in kleinen Gruppen (3-4 Personen)
Geräte:
- Becherglas (250 ml)
- Kunststoffspritze (5 ml)
- Reagenzgläser
Chemikalien:
- Fehlingsche Lösung I und II
- Propinolaldehyd (1 ml)
- Glucose-Lösung
- Aceton
Sicherheitsmaßnahmen:
- Schutzbrille
- evtl. Schutzhandschuhe
Durchführung:
1. Ein Gemisch aus je 5 ml FEHLING-Lösung I und II und 1 ml Propionaldehyd wird in einem Bechergls erhitzt.
2. Der Versuchsaufbau wird noch einmal genau so nachgestellt, diesmal verwenden Sie jedoch anstatt Propionaldehyd Glucose-Lösung.
Zu beantworten:
- Welche Beobachtungen machen Sie?
- Wie lässt sich die Reaktion erklären?
Beobachtungen
Aufgaben
1. Vergleichen Sie die C=C-Zweifachbindung mit der C=O-Zweifachbindung hinsichtlich Bindungslänge, Bindungsenergie und Polarität.
2. Vergleichen Sie Alkane, Alkanole und Alkanale hinsichtlich ihrer Siedetemperatur und ihrer Wasserlöslichkeit. Begründen Sie Ihe Aussagen.
Lösungen
Quellen
Bücher:
- Chemie heute - Sekundarbereich II, Schroedel Verlag, Kapitel 14.5, Seite 262-264
Internet:
- http://de.wikipedia.org/wiki/Formaldehyd
- http://www.oci.unizh.ch
- http://www.chemgapedia.de
- Einige der verwandten internen Links bedienen sich schon vorhandenen Wikiseiten, andere wurden selbst verfasst.
14.5/6

