Elektronenmangel: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| Zeile 6: | Zeile 6: | ||
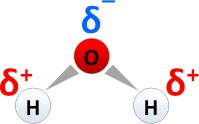
* [[P-Leiter]]: [[Halbleiter]]werkstoffe wie [[Silicium]] und [[Germanium]] ([[Ge]]), die mit [[Aluminium]] ([[Al]]), [[Gallium]] ([[Ga]]) oder [[Indium]] ([[In]]) gezielt dotiert ("verunreinigt") sind, besitzen einen Elektronenmangel.[[Bild:Wasser-Dipol.png|199px|right|Ladungsverschiebung in Richtung Sauerstoff im H<sub>2</sub>O-Molekül führt zu einer positiven Partialladung am Wasserstoffatom]] | * [[P-Leiter]]: [[Halbleiter]]werkstoffe wie [[Silicium]] und [[Germanium]] ([[Ge]]), die mit [[Aluminium]] ([[Al]]), [[Gallium]] ([[Ga]]) oder [[Indium]] ([[In]]) gezielt dotiert ("verunreinigt") sind, besitzen einen Elektronenmangel.[[Bild:Wasser-Dipol.png|199px|right|Ladungsverschiebung in Richtung Sauerstoff im H<sub>2</sub>O-Molekül führt zu einer positiven Partialladung am Wasserstoffatom]] | ||
* polare Atombindung: Ladungsverschiebung in Richtung des Bindungspartners mit der höheren [[Elektronegativität]] führt zu Elektronenmangel und damit zu einer positiven Partialladung <span style="color: red">δ<sup>+</sup></span>, z. B. am Wasserstoffatom im [[Wasser]]molekül (Bild) | * polare Atombindung: Ladungsverschiebung in Richtung des Bindungspartners mit der höheren [[Elektronegativität]] führt zu Elektronenmangel und damit zu einer positiven Partialladung <span style="color: red">δ<sup>+</sup></span>, z. B. am Wasserstoffatom im [[Wasser]]molekül (Bild) | ||
| − | * [[elektrophil]]e Teilchen sind z. B. Atome von [[Periodensystem der Elemente (PSE)|Elementen]] mit einer hohen [[Elektronegativität]] wie die [[Halogene]]. Bei einer chemischen Reaktion greifen die elektrophilen Teilchen [[nucleophil|Molekülbereiche mit Elektronenüberschuss]] an, z. B. die C-C-Doppelbindung in [[Alkene]]n. | + | * [[elektrophil]]e Teilchen sind z. B. Atome von [[Periodensystem der Elemente (PSE)|Elementen]] mit einer hohen [[Elektronegativität]] wie die [[Halogene]]. Bei einer chemischen Reaktion greifen die elektrophilen Teilchen [[nucleophil|Molekülbereiche mit Elektronenüberschuss]] an, z. B. die C-C-[[Doppelbindung]] in [[Alkene]]n. |
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
Version vom 29. März 2012, 13:54 Uhr
Eine Triebkraft chemischer Reaktionen ist der Kampf um Elektronen, d. h. eine ungleichmäßige Ladungsverteilung wie z. B. Elektronenmangel drängt naturgemäß auf Ausgleich. So erleichtert die Kenntnis bzw. Veranschaulichung des Elektronenmangels die Vorhersage des Verlaufes einer chemischen Reaktion.
Elektronenmangel (Gegenteil: Elektronenüberschuss) bedeutet weniger Elektronen als Protonen oder wenige Elektronen in einem Molekülbereich, z. B.:
- positiv geladenes Ion, also Kationen wie z. B. Metallionen oder H+-Ionen
- elektrischer Pluspol
- P-Leiter: Halbleiterwerkstoffe wie Silicium und Germanium (Ge), die mit Aluminium (Al), Gallium (Ga) oder Indium (In) gezielt dotiert ("verunreinigt") sind, besitzen einen Elektronenmangel.
- polare Atombindung: Ladungsverschiebung in Richtung des Bindungspartners mit der höheren Elektronegativität führt zu Elektronenmangel und damit zu einer positiven Partialladung δ+, z. B. am Wasserstoffatom im Wassermolekül (Bild)
- elektrophile Teilchen sind z. B. Atome von Elementen mit einer hohen Elektronegativität wie die Halogene. Bei einer chemischen Reaktion greifen die elektrophilen Teilchen Molekülbereiche mit Elektronenüberschuss an, z. B. die C-C-Doppelbindung in Alkenen.