Ozon: Experimente: Unterschied zwischen den Versionen
Inchen (Diskussion | Beiträge) (→'''''Schülerversuch: 5 Minuten''''') |
Dg (Diskussion | Beiträge) |
||
| Zeile 82: | Zeile 82: | ||
| − | + | [[Bild:Bild:Ozon Versuch 1.jpg]] | |
| + | |||
| + | [[Bild:Bild:Ozon Versuch 2.jpg]] | ||
| + | |||
| + | [[Bild:Bild:Ozon Versuch 3.jpg]] | ||
--[[Benutzer:Inchen|Inchen]] 08:03, 26. Jan. 2009 (CET) | --[[Benutzer:Inchen|Inchen]] 08:03, 26. Jan. 2009 (CET) | ||
Version vom 9. Februar 2009, 12:00 Uhr
Versuch: Wirkung von Ozon auf Pflanzen
Schülerversuch: 30 min.
Geräte
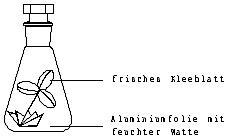
2 Erlenmeyerkolben (250 ml) mit Glasstopfen. Watte, Kunststoff- oder Alufolie.
Chemikalien
Ozonhaltiges Anodengas (Xi).
Durchführung
Je ein Blatt von frisch gepflücktem Weißklee oder einer anderen empfindlichen Pflanze wird in feuchte Watte gesteckt. Die Watte wird (um das Austrocknen zu verhindern) mit Folie umwickelt. Die so präparierten "Pflanzen" werden in je einen Erlenmeyerkolben gestellt. Zu einem von den beiden gibt man 100 ml ozonhaltiges Anodengas. Man lässt die Blätter im hellen Licht stehen.
Auswertung/Ergebnis des Versuches
Schon nach kurzer Zeit, spätestens aber nach 60 min beobachtet man, wie sich in der ozonhaltigen Atmosphäre die Unterblatt-Epidermis weiß färbt und ablöst. Das Blatt beginnt sich dunkel zu färben und zusammenzurollen. Das Blatt in der unbelasteten Probe sieht weiterhin frisch aus.
Versuch: Zerstörung von Gummi durch Ozon
Schülerversuch: 5 Minuten
Geräte:
Luftballons
Chemikalien:
Ozonhaltiges Anodengas (Xi)
Bei einem Gewitter kann Ozon durch den elektrischen Stromfluss zwischen Wolke und Erdboden bei der Blitzentladung entstehen. Durch diese Blitzentladung werden Sauerstoffmoleküle in zwei einzelne Sauerstoffradikale gespalten. Diese Sauerstoffradikale sind sehr reaktionsfreudig und verbinden sich jeweils mit einem weiteren Sauerstoffmolekül zu Ozon.
Um ozonhaltiges Anodengas herzustellen, ahmen wir das Gewitter nach. Dazu benötigen wir ein U-Rohr, das mit Anode und Kathode ausgestattet ist und schließen beide an einen Transformator an. Des Weiteren verbinden wir das U-Rohr durch einen Silikonschlauch mit einer Sauerstoffflasche. Nun erzeugen wir im U-Rohr mithilfe des Transformators eine Spannung von 15-20 Volt und lassen durch den Silikonschlauch etwas Sauerstoff in das U-Rohr strömen.
An der Kathode trifft der Sauerstoff dann auf die Spannung von 15-20 Volt. Dies hat zur Folge, dass sich Sauerstoffmoleküle in zwei einzelne Sauerstoffradikale spalten und sich jeweils mit einem weiteren Sauerstoffmolekül verbinden. Also entsteht an der Anode ein Sauerstoff-Ozon-Gemisch.
Durchführung:
Man pustet einen Luftballon auf. Anschließend leitet man etwas ozonhaltiges Anodengas auf die Ballonhülle.
Ergebnis:
An der Stelle, wo das Ozon auf die Luftballonhülle trifft, trübt diese sich augenblicklich und verfärbt sich weiß. Dann platzt der Luftballon.
Begründung:
Das Ozon spaltet die Doppelbindungen des Gummis. Deswegen platzt der Luftballon. |Datei:Bild:Ozon Versuch 1.jpg
--Inchen 08:03, 26. Jan. 2009 (CET)