Peptidbindung: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) (→Aufgabe) |
Dg (Diskussion | Beiträge) (→Struktur der Peptidgruppe) |
||
| Zeile 31: | Zeile 31: | ||
==Struktur der Peptidgruppe== | ==Struktur der Peptidgruppe== | ||
| − | + | * Bestimmung der Bildungslänge in Peptidbindung durch Röntgenstrukturanalyse | |
| − | + | * C/N-Bindung ist kürzer als bei [[Amine]]n (Doppelbindungscharakter) | |
| − | + | * Peptid-Gruppe ist eben gebaut | |
| − | + | * durch die Delokalisierung der Peptidgruppe wird ein besonders stabiles Verbindungsverhältnis erreicht | |
| − | - | + | * [[Carbonyl-Gruppe|Amid-Gruppe]] ist planar gebaut, d. h. alle am Aufbau der der Verbindung beteiligten Atome liegen auf einer Ebene |
| − | + | * der Diederwinkel liegt daher bei 180°[[Bild:Pfeil.gif]]Atome können nicht verdreht werden | |
| − | + | * aus Grenzformeln ergibt sich, dass die C/N-Bindung Doppelbindungscharakter hat und so nicht frei drehbar[[Bild:Pfeil.gif]]Atome der Peptidbindung und benachbarte a-C-Atome sind daher in einer Ebene[[Bild:Pfeil.gif]]starre Struktureinheit | |
| − | + | * a-C-Atome können zur C/N-Bindung einer Peptid-Gruppe [[cis]] oder [[trans]] angeordnet sein[[Bild:Pfeil.gif]]aus sterischen Gründen meistens [[trans]] | |
| − | -Amid-Gruppe ist planar gebaut | + | * die Ausbildung einer Peptid-Gruppe beeinflusst die Struktur von [[Proteine]]n |
| − | + | * Verformungen sind nur an den a-C-Bindungen möglich, da diese[[Bild:Pfeil.gif]]tetraedrisch angeordnet und frei drehbar sind | |
| − | + | * Möglichkeit der [[Konformation]] ist deshalb bei [[Proteine]]n stark eingeschränkt | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
[[Bild:chemie.jpg]] Grenzformeln | [[Bild:chemie.jpg]] Grenzformeln | ||
| + | [[Bild:chemie2.jpg]]delokalisiertes Elektronensystem | ||
==Aufgabe== | ==Aufgabe== | ||
Version vom 4. Februar 2007, 22:31 Uhr
Inhaltsverzeichnis
Proteine
(Eiweiße, Eiweißstoffe, Eiweißkörper). Auf Berzelius zurückgehende u. seit Mulder (1838) gebräuchliche u. von griech.: proteuein = „der Erste sein“ abgeleitete Sammelbez. für natürlich vorkommende Copolymere, die sich in der Regel aus 20 verschiedenen a-Aminosäuren (im folgenden: AS) als Monomeren zusammensetzen. Von den nahe verwandten Polypeptiden werden sie aufgrund ihrer mol. Größe unterschieden, wenn auch nicht immer streng abgegrenzt: Ab etwa 100 Monomer-Einheiten (AS-Resten) spricht man meist von Proteinen. Es ergeben sich MR von 10 000 bis mehrere Millionen. siehe Artikel Proteine von Franci & Kathi
Peptide
(von griech.: peptos = verdaulich). Bez. für durch Peptid-Bindungen Säureamid-artig verknüpfte Kondensationsprodukte von Aminosäuren. Siehe Artikel Aminosäuren von Jana und Imke Spö.
Peptidbinung
Eine Peptidbindung (-NH-CO-) ist eine Bindung zwischen der Carboxylgruppe einer und der Aminogruppe einer zweiten Aminosäure.
Zwei Aminosäuren können (formal) unter Wasserabspaltung zu einem Dipeptid kondensieren.
Im Beispiel reagieren zwei Moleküle der einfachsten Aminosäure Glycin zu einem Dipeptid: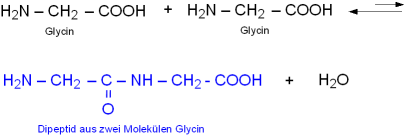
Struktur der Peptidgruppe
- Bestimmung der Bildungslänge in Peptidbindung durch Röntgenstrukturanalyse
- C/N-Bindung ist kürzer als bei Aminen (Doppelbindungscharakter)
- Peptid-Gruppe ist eben gebaut
- durch die Delokalisierung der Peptidgruppe wird ein besonders stabiles Verbindungsverhältnis erreicht
- Amid-Gruppe ist planar gebaut, d. h. alle am Aufbau der der Verbindung beteiligten Atome liegen auf einer Ebene
- der Diederwinkel liegt daher bei 180°
 Atome können nicht verdreht werden
Atome können nicht verdreht werden - aus Grenzformeln ergibt sich, dass die C/N-Bindung Doppelbindungscharakter hat und so nicht frei drehbar
 Atome der Peptidbindung und benachbarte a-C-Atome sind daher in einer Ebene
Atome der Peptidbindung und benachbarte a-C-Atome sind daher in einer Ebene starre Struktureinheit
starre Struktureinheit - a-C-Atome können zur C/N-Bindung einer Peptid-Gruppe cis oder trans angeordnet sein
 aus sterischen Gründen meistens trans
aus sterischen Gründen meistens trans - die Ausbildung einer Peptid-Gruppe beeinflusst die Struktur von Proteinen
- Verformungen sind nur an den a-C-Bindungen möglich, da diese
 tetraedrisch angeordnet und frei drehbar sind
tetraedrisch angeordnet und frei drehbar sind - Möglichkeit der Konformation ist deshalb bei Proteinen stark eingeschränkt
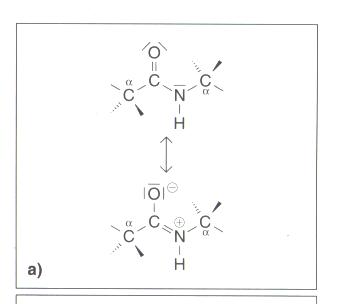 Grenzformeln
Grenzformeln
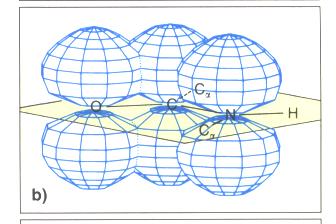 delokalisiertes Elektronensystem
delokalisiertes Elektronensystem
Aufgabe
Glutathion ist ein Tripeptid mit der Aminosäuresequenz (Glu-Cys-Gly). Es schützt in lebenden Zellen Verbindungen vor Oxidation. Dabei wird Glutathion selbst oxidiert. M(Glutathion) = 307 g · mol-1; M(Oxidationsprodukt) = 612 g · mol-1)
a) Gebe die Strukturformel des Tripeptids als Zwitterion an. Beachte dabei, dass Glutaminsäure im Glutathion eine γ-Peptidbindung ausbildet.
b) Leite die Strukturformel des Oxidationsproduktes aus den Angaben der molaren Massen ab.
c) Gebe die Reaktionsgleichung der Oxidation mit Hilfe der Strukturformeln an und benenne den entstehenden Bindungstyp.
Powerpointpräsentation
http://www.bs-wiki.de/mediawiki/images/Peptidbindung1.ppt
Versuch
Biuret-Reaktion Der Klassische Nachweis von Proteinen geschieht mit der Biuret-Reaktion.
Chemikalien: Eiklar-Lösung(Eiklar+ physiologische Kochsalz-Lösung,diverse Lebensmittel(Fleisch,Nudeln,Kartoffeln,Milch, u.a. Natronlauge 1-7% Geräte: Reagenzglas mit Stopfen,Reagenzglasständer,Reibschale mit Pistill,Tropfpipette,Messpipette 5ml
Durchführung: In das Reagenzglas gibt man etwa 2ml Eiklar-Lösung.Andere Lebensmittel werden in der Reibeschale zerkleinert,mit wenig Wasser aufgeschlämmt und vorsichtig erwärmt, dann werden etwa 2ml der Lösung in das Reagenzglas dekantiert.Man gibt nun 2 ml Natronlauge hinzu, verschließt das Glas mit dem Stopfen und schüttelt gut durch jetzt werden 3Tropfen der Kupfersulfat-Lösung zugefügt.
Ergebnis: Bei Anwesenheit von Protein entsteht ein gelber Fleck
Quellen
Chemie heute Seite 375 Kapitel 19.8,Römpp Lexikon Chemie – Version 2.0, Stuttgart/New York: Georg Thieme Verlag 1999 Versuch aus Unterricht Cemie BAnd 11 : lebnsmittel-Nährstoffe Heinz Schmidkunz, Karin Schlagheck Aulis verlag Deubner & Co KG
