Titandioxid: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) |
|||
| (20 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| + | {{navi|Chemie in Umwelt und Technik|Farbstoffe}} | ||
== Allgemein == | == Allgemein == | ||
{| {{Tabelle | {| {{Tabelle | ||
| Zeile 4: | Zeile 5: | ||
|- | |- | ||
| − | + | ||
| − | | | + | |Name |
| Titan(IV)-oxid | | Titan(IV)-oxid | ||
| − | |||
|- | |- | ||
| Verhältnisformel | | Verhältnisformel | ||
| Zeile 15: | Zeile 15: | ||
| | | | ||
* Titandioxid | * Titandioxid | ||
| − | * Titansäureanhydrid | + | * Titansäureanhydrid |
| − | * E 171 | + | * Titanweiß |
| + | * E 171 ([[Lebensmittelfarbstoff]]) | ||
|- | |- | ||
| − | | Aggregatzustand | + | | [[Aggregatzustand]] |
| fest | | fest | ||
|- | |- | ||
| − | | Molare Masse | + | | [[Molare Masse]] |
| − | | 79, | + | | 79,9 g{{*}}mol<sup>−1</sup> |
|- | |- | ||
| Schmelzpunkt | | Schmelzpunkt | ||
| − | | | + | | 1.855 °C |
|- | |- | ||
| Siedepunkt | | Siedepunkt | ||
| − | | | + | | 2.900 °C |
|} | |} | ||
| − | + | Titan(IV)-oxid (TiO<sub>2</sub>) ist ein Oxid des Elements [[Titan]] (Ti). Es ist in unserer Gesellschaft aufgrund seines großen Färbe- und Deckvermögens das bedeutendste Weißpigment ("Titanweiß"). Bei der Herstellung von Titandioxid entsteht als Nebenprodukt Dünnsäure. | |
| − | |||
| − | Titan(IV)-oxid (TiO<sub>2</sub>) ist ein Oxid des Elements Titan (Ti). Es ist in unserer Gesellschaft aufgrund seines | ||
| − | |||
| − | |||
== Verwendung == | == Verwendung == | ||
| − | + | In der Industrie verwendet man Titandioxid unter anderem als Zusatzstoff in [[Zahnpasta]] und Hustenbonbons, in Farben und Lacken, als Aufheller von Papier und Arzneimitteln, sowie in der Ölmalerei. Zudem dient es der Veredelung von Fliesen oder Putzen. | |
| − | In der Industrie verwendet man Titandioxid unter anderem als Zusatzstoff in Zahnpasta und Hustenbonbons, in Farben und Lacken, als Aufheller von Papier und Arzneimitteln, sowie in der Ölmalerei. Zudem dient es der Veredelung von Fliesen oder Putzen. | ||
| − | |||
| − | |||
| − | |||
== Vorkommen in der Natur == | == Vorkommen in der Natur == | ||
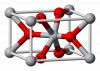
[[Bild:800px-Rutile-unit-cell-3D-balls.png|thumb|100px|Kristallstruktur des Titandioxids]] | [[Bild:800px-Rutile-unit-cell-3D-balls.png|thumb|100px|Kristallstruktur des Titandioxids]] | ||
| Zeile 50: | Zeile 43: | ||
Es gibt drei natürliche Formen: | Es gibt drei natürliche Formen: | ||
| − | + | *Rutil, welches so viel wie "rötlich" bedeutet und viel als Weißpigment eingesetzt wird | |
| − | + | *Anatas, welches ebenfalls viel Verwendung als Weißpigment findet und | |
| − | + | *Brookit, welches als einzige Modifikation nicht als Weißpigment dient | |
== Dünnsäure == | == Dünnsäure == | ||
| − | Dünnsäure (verdünnte Schwefelsäure) ist ein Abfallprodukt, das bei der Titandioxidherstellung entsteht. In der Vergangenheit wurde die Dünnsäure mit Schiffen in Meeren und Flüssen verklappt. Die Verklappung ist seit 1989 in der Bundesrepublik Deutschland eingestellt. Unternehmen entwickelten aufwändige Recyclingverfahren, durch die eine Rückgewinnung der Schwefelsäure ermöglicht wird. | + | Dünnsäure (verdünnte [[Schwefelsäure]]) ist ein Abfallprodukt, das bei der Titandioxidherstellung entsteht. In der Vergangenheit wurde die Dünnsäure mit Schiffen in Meeren und Flüssen verklappt. Die Verklappung ist seit 1989 in der Bundesrepublik Deutschland eingestellt. Unternehmen entwickelten aufwändige Recyclingverfahren, durch die eine Rückgewinnung der Schwefelsäure ermöglicht wird. |
| + | |||
In anderen Ländern, besonders in Asien, ist die Verklappung von Dünnsäure noch heute ein Problem. | In anderen Ländern, besonders in Asien, ist die Verklappung von Dünnsäure noch heute ein Problem. | ||
| + | == Experimente == | ||
| + | {{NiU|154|31 (2016)|Nachweis von Titan-Ionen in Titandioxid}} | ||
| + | === Verbrennen von Titan === | ||
| − | + | * '''Geräte:''' | |
| + | Lötlampe, Tonpfeife, Schlauch, Stativ | ||
| + | * '''Chemikalien:''' | ||
| + | Titangranulat (450-1000 µm), Sauerstoff | ||
| + | * '''Durchführung:''' | ||
| + | Die durch das Stativ befestigte Tonpfeife wird mit dem Schlauch verbunden, durch den der Sauerstoff geleitet werden soll. Danach wird das Titangranulat in den Pfeifenkopf gegeben, der mit der Lötlampe erhitzt wird. Dabei wird durch leichte Zufuhr von Sauerstoff, der durch die Pfeife in den Pfeifenkopf gelangt, die Verbrennung gefördert. | ||
| + | * '''Beobachtung''' | ||
| + | Es entstehen Funken, das Titangranulat wird heiß und verändert seine Farbe. | ||
| + | * '''Auswertung''' | ||
| + | Das Titan oxidiert mit dem Sauerstoff und reagiert zu Titandioxid. | ||
| + | [[Kategorie:Experiment]] | ||
| − | + | {{www}} | |
| − | + | [[Kategorie:Chemie]][[Kategorie:Chemikalien]][[Kategorie:Farbstoff]] | |
| + | [[Kategorie:Lebensmittelfarbstoff]] | ||
Aktuelle Version vom 14. Februar 2020, 13:44 Uhr
| Titandioxid | ||
|---|---|---|
| vernetzte Artikel | ||
| Chemie in Umwelt und Technik | Farbstoffe | |
Inhaltsverzeichnis
Allgemein
| Name | Titan(IV)-oxid |
| Verhältnisformel | TiO2 |
| Andere Namen |
|
| Aggregatzustand | fest |
| Molare Masse | 79,9 g · mol−1 |
| Schmelzpunkt | 1.855 °C |
| Siedepunkt | 2.900 °C |
Titan(IV)-oxid (TiO2) ist ein Oxid des Elements Titan (Ti). Es ist in unserer Gesellschaft aufgrund seines großen Färbe- und Deckvermögens das bedeutendste Weißpigment ("Titanweiß"). Bei der Herstellung von Titandioxid entsteht als Nebenprodukt Dünnsäure.
Verwendung
In der Industrie verwendet man Titandioxid unter anderem als Zusatzstoff in Zahnpasta und Hustenbonbons, in Farben und Lacken, als Aufheller von Papier und Arzneimitteln, sowie in der Ölmalerei. Zudem dient es der Veredelung von Fliesen oder Putzen.
Vorkommen in der Natur
Es gibt drei natürliche Formen:
- Rutil, welches so viel wie "rötlich" bedeutet und viel als Weißpigment eingesetzt wird
- Anatas, welches ebenfalls viel Verwendung als Weißpigment findet und
- Brookit, welches als einzige Modifikation nicht als Weißpigment dient
Dünnsäure
Dünnsäure (verdünnte Schwefelsäure) ist ein Abfallprodukt, das bei der Titandioxidherstellung entsteht. In der Vergangenheit wurde die Dünnsäure mit Schiffen in Meeren und Flüssen verklappt. Die Verklappung ist seit 1989 in der Bundesrepublik Deutschland eingestellt. Unternehmen entwickelten aufwändige Recyclingverfahren, durch die eine Rückgewinnung der Schwefelsäure ermöglicht wird.
In anderen Ländern, besonders in Asien, ist die Verklappung von Dünnsäure noch heute ein Problem.
Experimente
- Nachweis von Titan-Ionen in Titandioxid. In: Friedrich Verlag (Hrsg.): Naturwissenschaften im Unterricht Chemie (Zeitschrift), Heft 154, S. 31 (2016).
Verbrennen von Titan
- Geräte:
Lötlampe, Tonpfeife, Schlauch, Stativ
- Chemikalien:
Titangranulat (450-1000 µm), Sauerstoff
- Durchführung:
Die durch das Stativ befestigte Tonpfeife wird mit dem Schlauch verbunden, durch den der Sauerstoff geleitet werden soll. Danach wird das Titangranulat in den Pfeifenkopf gegeben, der mit der Lötlampe erhitzt wird. Dabei wird durch leichte Zufuhr von Sauerstoff, der durch die Pfeife in den Pfeifenkopf gelangt, die Verbrennung gefördert.
- Beobachtung
Es entstehen Funken, das Titangranulat wird heiß und verändert seine Farbe.
- Auswertung
Das Titan oxidiert mit dem Sauerstoff und reagiert zu Titandioxid.