Oxidationszahl: Lösungen: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) (→Propan) |
||
| (35 dazwischenliegende Versionen von 4 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | + | Ermittle die [[Oxidationszahl]]en der Atome in folgenden Verbindungen und [[Ionen]]! | |
| − | + | == Aufgabe 1 == | |
| − | |||
| − | |||
Cl<sub>2</sub>, H<sub>2</sub>S, H<sub>2</sub>O<sub>2</sub>, CO<sub>2</sub>, ClO<sub>2</sub>, HNO<sub>3</sub>, CH<sub>4</sub>, SiH<sub>4</sub>, NH<sub>3</sub>, P<sub>4</sub>O<sub>10</sub> | Cl<sub>2</sub>, H<sub>2</sub>S, H<sub>2</sub>O<sub>2</sub>, CO<sub>2</sub>, ClO<sub>2</sub>, HNO<sub>3</sub>, CH<sub>4</sub>, SiH<sub>4</sub>, NH<sub>3</sub>, P<sub>4</sub>O<sub>10</sub> | ||
| − | [[ | + | <br> |
| + | '''Lösungen:''' | ||
| + | <br> | ||
| + | {{oxi| 0|Cl<sub>2</sub>}} | ||
| + | {{oxi|I -II|H<sub>2</sub>S}} | ||
| + | Sonderfall Peroxid:<br /> | ||
| + | {{oxi|I -I|H<sub>2</sub>O<sub>2</sub>}} | ||
| + | {{oxi|IV -II|CO<sub>2</sub>}} | ||
| + | {{oxi|IV -II|ClO<sub>2</sub>}} | ||
| + | {{oxi|I V -II|HNO<sub>3</sub>}} | ||
| + | {{oxi|-IV I|CH<sub>4</sub>}} | ||
| + | Sonderfall [[Hydrid]]:<br /> | ||
| + | {{oxi|IV -I|SiH<sub>4</sub>}} | ||
| + | {{oxi|-III I| NH<sub>3</sub>}} | ||
| + | {{oxi|V -II|P<sub>4</sub>O<sub>10</sub>}} | ||
| − | + | == Aufgabe 2 == | |
Fe<sup>3+</sup>, NaH, H<sub>3</sub>O<sup>+</sup>, KMnO<sub>4</sub>, CrO<sub>4</sub><sup>2-</sup>, Cr<sub>2</sub>O<sub>7</sub><sup>2-</sup>, KClO<sub>3</sub>, S<sub>2</sub>O<sub>3</sub><sup>2-</sup> | Fe<sup>3+</sup>, NaH, H<sub>3</sub>O<sup>+</sup>, KMnO<sub>4</sub>, CrO<sub>4</sub><sup>2-</sup>, Cr<sub>2</sub>O<sub>7</sub><sup>2-</sup>, KClO<sub>3</sub>, S<sub>2</sub>O<sub>3</sub><sup>2-</sup> | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
<br> | <br> | ||
| + | '''Lösungen:''' | ||
<br> | <br> | ||
| − | |||
{{oxi| III|Fe<sup>3+</sup>}} | {{oxi| III|Fe<sup>3+</sup>}} | ||
| − | + | {{oxi| I -I|NaH}} [[Oxidationszahl#Regeln_zur_Ermittlung_von_Oxidationszahlen|Wasserstoff in Hydriden -I]] | |
| − | {{oxi| I -I|NaH}} | ||
{{oxi| I -II|H<sub>3</sub>O<sup>+</sup>}} | {{oxi| I -II|H<sub>3</sub>O<sup>+</sup>}} | ||
| Zeile 47: | Zeile 42: | ||
== Aufgabe 3 == | == Aufgabe 3 == | ||
| − | {{oxi|-II I -II I|CH<sub>3</sub>OH}} | + | [[Methanol]], [[Formaldehyd]], [[Ameisensäure]], [[Benzol]], [[Propan]], [[Glucose]], [[Propanon]], [[Chloroform]] |
| − | {{oxi| | + | |
| − | {{oxi| I - | + | <br> |
| − | {{oxi| | + | '''Lösungen:''' |
| − | {{oxi| - I| | + | <br> |
| − | === Glucose === | + | |
| + | ====Methanol==== | ||
| + | {{oxi| -II I -II I| CH<sub>3</sub>OH}} | ||
| + | <br> | ||
| + | |||
| + | ====Formaldehyd==== | ||
| + | {{oxi| 0 I -II|CH<sub>2</sub>O}} | ||
| + | <br> | ||
| + | |||
| + | ====Ameisensäure==== | ||
| + | {{oxi|II I -II|CH<sub>2</sub>O<sub>2</sub>}} | ||
| + | <br> | ||
| + | |||
| + | ====Benzol==== | ||
| + | {{oxi|-I I|C<sub>6</sub>H<sub>6</sub>}} | ||
| + | <br> | ||
| + | |||
| + | ====Propan==== | ||
| + | {{oxi|-III I -II I -III I|CH<sub>3</sub>-CH<sub>2</sub>-CH<sub>3</sub>}} | ||
| + | <br> | ||
| + | |||
| + | ==== Glucose ==== | ||
{| | {| | ||
| {{oxi||C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>}} | | {{oxi||C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>}} | ||
| Zeile 58: | Zeile 74: | ||
|} | |} | ||
| − | === Propanon === | + | ==== Propanon ==== |
{| | {| | ||
| {{oxi| |C<sub>3</sub>H<sub>6</sub>O}} | | {{oxi| |C<sub>3</sub>H<sub>6</sub>O}} | ||
| [[Bild:Propanon oz.gif]] | | [[Bild:Propanon oz.gif]] | ||
|} | |} | ||
| + | <br> | ||
| + | ==== Chloroform ==== | ||
| + | {{oxi| II I -I| CHCl<sub>3</sub>}} | ||
| + | |||
| + | == Aufgabe 4 == | ||
| + | |||
| + | <br> | ||
| + | Ermittle die Oxidationszahlen für die folgenden Lebensvorgänge bzw. Stoffwechselreaktionen. Formuliere zunächst die Reaktionsgleichungen: | ||
| + | |||
| + | a) Atmung als Oxidation organischer Stoffe am Beispiel [[Glucose]] | ||
| + | |||
| + | '''Lösung:''' | ||
| + | |||
| + | [[Bild:Glucose oz.gif|left]]<br><br><br><br><br><br> | ||
| + | {{oxi| 0 IV -II I -II| + 6O<sub>2</sub>[[Bild:Pfeil.gif]]6CO<sub>2</sub> + 6H<sub>2</sub>O}} | ||
| + | |||
| − | |||
| − | |||
| + | <br> | ||
| + | * b) „Schwefelatmung“ der Archae-Bakterien, die [[Glucose]] mit [[Schwefel]] und Wasser zu Schwefelwasserstoff und [[Kohlendioxid]] umsetzen. Der [[Schwefel]] wird bei dieser Reaktion reduziert: '''C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> + 12S + 6H<sub>2</sub>O [[Bild:Pfeil.gif]] 6CO<sub>2</sub> + 12H<sub>2</sub>S''' | ||
| + | <br> | ||
| + | '''Lösung:''' | ||
| + | <br> | ||
| + | {{oxi| 0 I -II|C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>}} + {{oxi| 0|12S}} + {{oxi| I -II|6H<sub>2</sub>O}} [[Bild:Pfeil.gif]] {{oxi| IV -II|6CO<sub>2</sub>}} + {{oxi| I -II|12H<sub>2</sub>S}} | ||
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
Aktuelle Version vom 19. August 2017, 08:38 Uhr
Ermittle die Oxidationszahlen der Atome in folgenden Verbindungen und Ionen!
Inhaltsverzeichnis
Aufgabe 1
Cl2, H2S, H2O2, CO2, ClO2, HNO3, CH4, SiH4, NH3, P4O10
Lösungen:
0
Cl2
I -II
H2S
Sonderfall Peroxid:
I -I
H2O2
IV -II
CO2
IV -II
ClO2
I V -II
HNO3
-IV I
CH4
Sonderfall Hydrid:
IV -I
SiH4
-III I
NH3
V -II
P4O10
Aufgabe 2
Fe3+, NaH, H3O+, KMnO4, CrO42-, Cr2O72-, KClO3, S2O32-
Lösungen:
III
Fe3+
I -I
NaH
Wasserstoff in Hydriden -I
I -II
H3O+
I VII -II
KMnO4
VI -II
CrO42-
I V -II
KClO3
II -II
S2O32-
Aufgabe 3
Methanol, Formaldehyd, Ameisensäure, Benzol, Propan, Glucose, Propanon, Chloroform
Lösungen:
Methanol
-II I -II I
CH3OH
Formaldehyd
0 I -II
CH2O
Ameisensäure
II I -II
CH2O2
Benzol
-I I
C6H6
Propan
-III I -II I -III I
CH3-CH2-CH3
Glucose
| [[Oxidationszahl|]]
|
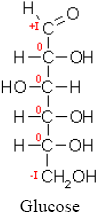
|
Propanon
|
|
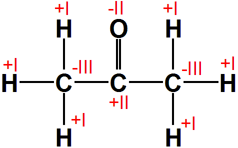
|
Chloroform
II I -I
CHCl3
Aufgabe 4
Ermittle die Oxidationszahlen für die folgenden Lebensvorgänge bzw. Stoffwechselreaktionen. Formuliere zunächst die Reaktionsgleichungen:
a) Atmung als Oxidation organischer Stoffe am Beispiel Glucose
Lösung:
0 IV -II I -II
+ 6O2![]() 6CO2 + 6H2O
6CO2 + 6H2O
- b) „Schwefelatmung“ der Archae-Bakterien, die Glucose mit Schwefel und Wasser zu Schwefelwasserstoff und Kohlendioxid umsetzen. Der Schwefel wird bei dieser Reaktion reduziert: C6H12O6 + 12S + 6H2O
 6CO2 + 12H2S
6CO2 + 12H2S
Lösung:
0 I -II
C6H12O6
+ 0
12S
+ I -II
6H2O
![]() IV -II
IV -II
6CO2
+ I -II
12H2S