Anode: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| (5 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
{{navi|Oxidation|Kathode}} | {{navi|Oxidation|Kathode}} | ||
| − | In der Chemie ist diejenige Elektrode als Anode definiert, an der | + | In der Chemie ist diejenige Elektrode als Anode definiert, an der von Teilchen (Atome, Ionen) eine Elektronenabgabe (also eine [[Oxidation]]) erfolgt. Die Polung ist |
| − | eine Elektronenabgabe (also eine [[Oxidation]]) erfolgt. Die Polung ist | ||
dabei von der Betriebsart abhängig: | dabei von der Betriebsart abhängig: | ||
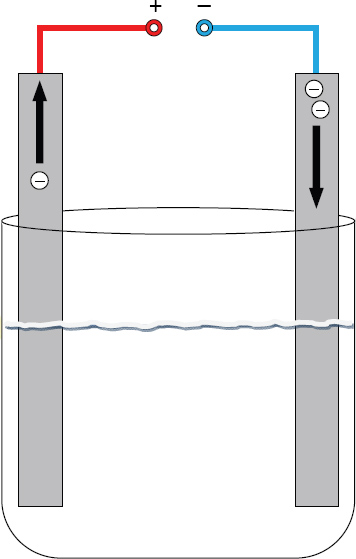
* Bei der [[Elektrolyse]] entspricht die Anode dem [[Pluspol]]. Dieser zieht die [[Anionen|negativ geladenen Ionen]] aus der Lösung an und entreißt ihnen Elektronen, die Ionen werden oxidiert, die Elektrode (vereinfachend) bleibt chemisch unverändert, weil die Elektronen im äußeren Stromkreis abgeleitet werden.[[Bild:Elektroden.jpg|right]] | * Bei der [[Elektrolyse]] entspricht die Anode dem [[Pluspol]]. Dieser zieht die [[Anionen|negativ geladenen Ionen]] aus der Lösung an und entreißt ihnen Elektronen, die Ionen werden oxidiert, die Elektrode (vereinfachend) bleibt chemisch unverändert, weil die Elektronen im äußeren Stromkreis abgeleitet werden.[[Bild:Elektroden.jpg|right]] | ||
| − | * In [[galvanisches Element|galvanischen Elementen]] wie z. B. der [[Brennstoffzelle]] entspricht die Anode dem [[Minuspol]]. Im Gegensatz zur Elektrolyse ist also das Anodenmaterial selbst Reaktionspartner, d. h. ein z. B. unedles Anoden-Metall bildet durch Elektronenabgabe [[Kationen|positiv geladenen Ionen]] und wird dabei oxidiert. | + | * In [[galvanisches Element|galvanischen Elementen]] wie z. B. der [[Brennstoffzelle]] entspricht die Anode dem [[Minuspol]]. Im Gegensatz zur Elektrolyse ist also das Anodenmaterial selbst Reaktionspartner, d. h. ein z. B. unedles Anoden-Metall wie z.B. '''Zink''' bildet durch Elektronenabgabe [[Kationen|positiv geladenen Ionen]] und wird dabei oxidiert. |
Der Name Anode leitet sich vom griech. ''anodos'' ab und bedeutet ''aufwärts führender Weg'' und geht von der Vorstellung aus, dass die Elektronen durch den ''Elektronensog'' an der Anode aus der Lösung in die Anode geleitet werden (Elektrolyse) bzw. aus der Anode in den äußeren Stromkreis ([[galvanisches Element]]), siehe Bild. | Der Name Anode leitet sich vom griech. ''anodos'' ab und bedeutet ''aufwärts führender Weg'' und geht von der Vorstellung aus, dass die Elektronen durch den ''Elektronensog'' an der Anode aus der Lösung in die Anode geleitet werden (Elektrolyse) bzw. aus der Anode in den äußeren Stromkreis ([[galvanisches Element]]), siehe Bild. | ||
| + | |||
| + | == Experimente == | ||
| + | * [[Elektrolyse]] | ||
| + | * [[Galvanische Zelle]] | ||
| + | |||
| + | {{www}} | ||
| + | * [http://www.chemieunterricht.de/dc2/tip/07_02.htm Prof. Blume: Anmerkungen zu den Begriffen Anode und Kathode] | ||
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
Aktuelle Version vom 21. Januar 2018, 18:01 Uhr
In der Chemie ist diejenige Elektrode als Anode definiert, an der von Teilchen (Atome, Ionen) eine Elektronenabgabe (also eine Oxidation) erfolgt. Die Polung ist dabei von der Betriebsart abhängig:
- Bei der Elektrolyse entspricht die Anode dem Pluspol. Dieser zieht die negativ geladenen Ionen aus der Lösung an und entreißt ihnen Elektronen, die Ionen werden oxidiert, die Elektrode (vereinfachend) bleibt chemisch unverändert, weil die Elektronen im äußeren Stromkreis abgeleitet werden.
- In galvanischen Elementen wie z. B. der Brennstoffzelle entspricht die Anode dem Minuspol. Im Gegensatz zur Elektrolyse ist also das Anodenmaterial selbst Reaktionspartner, d. h. ein z. B. unedles Anoden-Metall wie z.B. Zink bildet durch Elektronenabgabe positiv geladenen Ionen und wird dabei oxidiert.
Der Name Anode leitet sich vom griech. anodos ab und bedeutet aufwärts führender Weg und geht von der Vorstellung aus, dass die Elektronen durch den Elektronensog an der Anode aus der Lösung in die Anode geleitet werden (Elektrolyse) bzw. aus der Anode in den äußeren Stromkreis (galvanisches Element), siehe Bild.