Elektronenüberschuss: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) (Die Seite wurde neu angelegt: Elektronenüberschuss (Gegenteil: Elektronenmangel) bedeutet mehr Elektronen als Protonen oder viele Elektronen in einem Molekülbereich, z. B.: * nega...) |
Dg (Diskussion | Beiträge) |
||
| (12 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | + | Eine Triebkraft chemischer Reaktionen ist der Kampf um [[Elektron]]en, d. h. eine ungleichmäßige Ladungsverteilung wie z. B. {{PAGENAME}} drängt [[elektrostatische Wechselwirkung|naturgemäß auf Ausgleich]]. So erleichtert die Kenntnis bzw. Veranschaulichung des Elektronenüberschusses die Vorhersage des Verlaufes einer chemischen Reaktion. | |
| − | * negativ geladenes [[Ion]] ('''Anionen''' wie z. B. Nichtmetallionen wie | + | |
| − | * | + | {{PAGENAME}} (Gegenteil: [[Elektronenmangel]]) bedeutet mehr [[Elektron]]en als [[Proton]]en oder viele Elektronen in einem Molekülbereich, z. B.: |
| − | * | + | * negativ geladenes [[Ion]] ('''Anionen''' wie z. B. Nichtmetallionen (wie [[Halogenid]]e) oder [[Base|OH<sup>-</sup>]] |
| − | * | + | * elektrischer [[Minuspol]] |
| + | * [[N-Leiter]]: [[Halbleiter]]werkstoffe wie [[Silicium]] und [[Germanium]] ([[Ge]]), die mit [[Phosphor]] ([[P]]), [[Arsen]] ([[As]]) oder [[Antimon]] ([[Sb]]) gezielt dotiert ("verunreinigt") sind, besitzen einen Elektronenüberschuss. Diese freien [[Elektron]]en können sich wie in einem metallischen Leiter frei bewegen. | ||
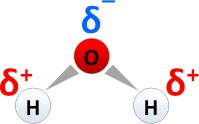
| + | * C-C-Mehrfachbindung in [[Alkene]]n und [[Alkine]]n.[[Bild:Wasser-Dipol.png|199px|right|Ladungsverschiebung in Richtung Sauerstoff im H<sub>2</sub>O-Molekül führt zu einer negativen Partialladung am Sauerstoffatom]] | ||
| + | * polare Atombindung: Ladungsverschiebung in Richtung des Bindungspartners mit der höheren [[Elektronegativität]] führt zu Elektronenüberschuss und damit zu einer negativen Partialladung <span style="color: blue">δ<sup>-</sup></span>, z. B. am Sauerstoffatom im [[Wasser]]molekül (Bild) | ||
| + | * [[nucleophil]]e Teilchen, also Atome von elektronenreichen [[Periodensystem der Elemente (PSE)|Elementen]] mit freien Elektronenpaaren wie [[Stickstoff]]. Bei einer chemischen Reaktion greifen die nucleophilen Teilchen [[elektrophil|Molekülbereiche mit Elektronenmangel]] an. | ||
| + | |||
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
| + | [[Kategorie:Stoffeigenschaft]] | ||
Aktuelle Version vom 17. Januar 2017, 13:38 Uhr
Eine Triebkraft chemischer Reaktionen ist der Kampf um Elektronen, d. h. eine ungleichmäßige Ladungsverteilung wie z. B. Elektronenüberschuss drängt naturgemäß auf Ausgleich. So erleichtert die Kenntnis bzw. Veranschaulichung des Elektronenüberschusses die Vorhersage des Verlaufes einer chemischen Reaktion.
Elektronenüberschuss (Gegenteil: Elektronenmangel) bedeutet mehr Elektronen als Protonen oder viele Elektronen in einem Molekülbereich, z. B.:
- negativ geladenes Ion (Anionen wie z. B. Nichtmetallionen (wie Halogenide) oder OH-
- elektrischer Minuspol
- N-Leiter: Halbleiterwerkstoffe wie Silicium und Germanium (Ge), die mit Phosphor (P), Arsen (As) oder Antimon (Sb) gezielt dotiert ("verunreinigt") sind, besitzen einen Elektronenüberschuss. Diese freien Elektronen können sich wie in einem metallischen Leiter frei bewegen.
- C-C-Mehrfachbindung in Alkenen und Alkinen.
- polare Atombindung: Ladungsverschiebung in Richtung des Bindungspartners mit der höheren Elektronegativität führt zu Elektronenüberschuss und damit zu einer negativen Partialladung δ-, z. B. am Sauerstoffatom im Wassermolekül (Bild)
- nucleophile Teilchen, also Atome von elektronenreichen Elementen mit freien Elektronenpaaren wie Stickstoff. Bei einer chemischen Reaktion greifen die nucleophilen Teilchen Molekülbereiche mit Elektronenmangel an.