Stöchiometrie: Lösungen: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) (→Airbag) |
Dg (Diskussion | Beiträge) (→Airbag) |
||
| (Eine dazwischenliegende Version desselben Benutzers wird nicht angezeigt) | |||
| Zeile 4: | Zeile 4: | ||
#[[Molare Masse]]''n'' berechnen: ''M(NaN<sub>3</sub>)'' = 65 g/mol; ''M(N<sub>2</sub>)'' = 28 g/mol | #[[Molare Masse]]''n'' berechnen: ''M(NaN<sub>3</sub>)'' = 65 g/mol; ''M(N<sub>2</sub>)'' = 28 g/mol | ||
# Verhältnisgleichung unter Berücksichtigung der stöchiometrischen Faktoren gemäß Reaktionsgleichung aufstellen: ''m(NaN<sub>3</sub>)'' = 10{{*}}''M''(NaN<sub>3</sub>){{*}}''m''(N<sub>2</sub>) / 16{{*}}''M''(N<sub>2</sub>) | # Verhältnisgleichung unter Berücksichtigung der stöchiometrischen Faktoren gemäß Reaktionsgleichung aufstellen: ''m(NaN<sub>3</sub>)'' = 10{{*}}''M''(NaN<sub>3</sub>){{*}}''m''(N<sub>2</sub>) / 16{{*}}''M''(N<sub>2</sub>) | ||
| − | # Nebenrechnung: ''m''(N<sub>2</sub>) aus dem Volumen berechnen: ''m''(N<sub>2</sub>) = ''V''(N<sub>2</sub>){{*}}''M''(N<sub>2</sub>) / ''[[molares Volumen|V<sub>m</sub>]]'' = 60 L{{*}}28 g/mol / 24 L/mol | + | # Nebenrechnung: ''m''(N<sub>2</sub>) aus dem Volumen berechnen: ''m''(N<sub>2</sub>) = ''V''(N<sub>2</sub>){{*}}''M''(N<sub>2</sub>) / ''[[molares Volumen|V<sub>m</sub>]]'' = 60 L{{*}}28 g/mol / 24 L/mol = 70 g |
| − | #Einsetzen: ''m''(NaN<sub>3</sub>) = 10{{*}}65 g/mol{{*}} | + | #Einsetzen: ''m''(NaN<sub>3</sub>) = 10{{*}}65 g/mol{{*}}70 g / 16{{*}}28 g/mol |
| − | #Ergebnis berechnen: <u>''m''(NaN<sub>3</sub>) = | + | #Ergebnis berechnen: <u>''m''(NaN<sub>3</sub>) = 101,6 g</u> |
== Roheisenherstellung == | == Roheisenherstellung == | ||
Aktuelle Version vom 25. Februar 2016, 17:08 Uhr
Airbag
a) Wie viel Natriumazid (NaN3) wird benötigt, um einen Fahrer-Airbag mit 60 Liter Stickstoff zu befüllen?
- Reaktionsgleichung formulieren: 10 NaN3 + 2 KNO3 + 6 SiO2
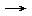 16 N2 + 5 Na2SiO3 + K2SiO3
16 N2 + 5 Na2SiO3 + K2SiO3 - Molare Massen berechnen: M(NaN3) = 65 g/mol; M(N2) = 28 g/mol
- Verhältnisgleichung unter Berücksichtigung der stöchiometrischen Faktoren gemäß Reaktionsgleichung aufstellen: m(NaN3) = 10 · M(NaN3) · m(N2) / 16 · M(N2)
- Nebenrechnung: m(N2) aus dem Volumen berechnen: m(N2) = V(N2) · M(N2) / Vm = 60 L · 28 g/mol / 24 L/mol = 70 g
- Einsetzen: m(NaN3) = 10 · 65 g/mol · 70 g / 16 · 28 g/mol
- Ergebnis berechnen: m(NaN3) = 101,6 g
Roheisenherstellung
a) Wie viel Eisenoxid muss eingesetzt werden, um 10 Tonnen reines Eisen zu gewinnen?
- Reaktionsgleichung formulieren: 2 Fe2O3 + 3 C
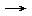 4 Fe + 3 CO2
4 Fe + 3 CO2 - Molare Massen berechnen: M(Fe2O3) = 159,697 g/mol; M(Fe) = 55,85 g/mol
- Verhältnisgleichung unter Berücksichtigung der stöchiometrischen Faktoren gemäß Reaktionsgleichung aufstellen: m(Fe2O3) = 2 · M(Fe2O3) · m(Fe) / 4 · M(Fe)
- Einsetzen: m(Fe2O3) = 159,697 g/mol · 10 t / 2 · 55,85 g/mol
- Ergebnis berechnen: m(Fe2O3) = 14,3 t bzw. 14.297 kg