Indikatoren: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) (→Quellen) |
Dg (Diskussion | Beiträge) (→Übungsaufgabe) |
||
| Zeile 30: | Zeile 30: | ||
* Hier kannst du deine [[Indikatoren: Antworten|Beobachtung kontrollieren]]. | * Hier kannst du deine [[Indikatoren: Antworten|Beobachtung kontrollieren]]. | ||
| − | == | + | == Musteraufgabe == |
| − | + | Berechne den [[PH-Wert-Berechnung|pH-Wert]] von Essigsäure (schwache Säure). | |
| − | + | '''Gegeben:''' c = 0,01 mol·l<sup>-1</sup> ; pK<sub>S</sub> = 4,65 | |
| − | + | '''Gesucht:''' pH-Wert | |
| − | + | '''Lösungsformel:''' pH = 1/2 · (pK<sub>S</sub> - lg c(HA)) | |
| − | pH=1/ | ||
| − | + | '''Einsetzen:''' pH = 1/2 · (4,65 - lg 0,01 mol·l<sup>-1</sup>) | |
| − | pH=1/ | + | pH = 1/2 · (4,65 + 2) |
| − | + | pH = 3,325 | |
| − | |||
| − | pH=3,325 | ||
| − | |||
| − | |||
| − | |||
| − | |||
| + | pH ≈ 3,33 | ||
| + | '''Lösung:''' Der pH-Wert von Essigsäure mit der Konzentration c = 0,01 mol·l<sup>-1</sup> beträgt 3,33. | ||
==Power Point Präsentation== | ==Power Point Präsentation== | ||
Version vom 20. Januar 2006, 00:21 Uhr
Inhaltsverzeichnis
Was sind Indikatoren?
Das Wort Indikator leitet sich von dem lat. Wort "indicare" ab, was "anzeigen" bedeutet. In der Chemie ist ein Indikator ein Stoff oder ein Gerät, welches zur Überwachung von einer chemischen Reaktion oder eines chemischen Zustandes dient.
Säure/Base-Indikatoren
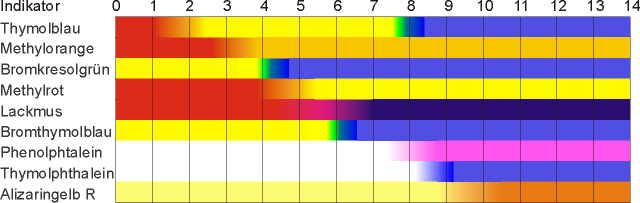
Säure/Base-Indikatoren sind im allgemeinen organische Säuren, welche sich in ihrer Farbe zur korrespondierenden Base unterscheiden. Bsp.: Gibt man zu dem Indikator Methylorange eine (starke) Säure, ist eine rote Färbung erkennbar. Gibt man eine Base hinzu, färbt sich der Indikator gelb (siehe auch Bild 1).
Umschlagsbereiche von Säure/Base-Indikatoren
Die Farbe eines Indikators ergibt sich aus dem Gleichgewicht von Säure zu korrespondierender Base. Ein Farbwechsel ist allerdings erst beim 10-fachen Überschuss einer der Komponenten vollständig auf der pH-Skala sichtbar. Indikatoren können einen bis zwei Umschlagsbereiche (Bild 1) besitzen.
Das pH-Meter
Das pH-Meter (Bild 2) dient zur schnellen und genauen Bestimmung von pH-Werten. Durch eine Elektrode erzeugt es eine Spannung, welche vom pH-Wert abhängt. Alternativ ist der pH-Wert auch zu berechnen, siehe Übungsaufgabe.
Versuch
Damit du die Wirkung von Indikatoren besser nachvollziehen kannst, haben wir hier einen einfachen Versuch für dich.
Materialien: 2 Bechergläser, 1 Teelöffel, Schwarzer Tee (zubereitet, jedoch nicht zu stark, evtl. mit Wasser verdünnen), Zitronensaft, Spülmittel (nicht pH-Haut-neutral!)
Durchführung:
- Beide Bechergläser mit schwarzem Tee füllen.
- In das eine B. den Zitronensaft und in das andere Spülmittel hinzugeben und gut umrühren.
Beobachtung?
- Hier kannst du deine Beobachtung kontrollieren.
Musteraufgabe
Berechne den pH-Wert von Essigsäure (schwache Säure).
Gegeben: c = 0,01 mol·l-1 ; pKS = 4,65
Gesucht: pH-Wert
Lösungsformel: pH = 1/2 · (pKS - lg c(HA))
Einsetzen: pH = 1/2 · (4,65 - lg 0,01 mol·l-1)
pH = 1/2 · (4,65 + 2)
pH = 3,325
pH ≈ 3,33
Lösung: Der pH-Wert von Essigsäure mit der Konzentration c = 0,01 mol·l-1 beträgt 3,33.
Power Point Präsentation
In dieser Präsentation ist auch noch ein zweiter Versuch zu finden
Powerpoint-Präsentation zum Thema Indikatoren
Fragen
1. In einer Natriumhydrogencarbonat-Lösung zeigt Phenolphthalein eine blassrosa Färbung. Welcher pH-Wert wird dadurch ungefähr angezeigt?
2. Was passiert mit Thymolblau, wenn man eine Säure mit dem pH-Wert 1 hinzufügt?
Quellen
- Bild Indikatoren: de.wikipedia.org/wiki/Bild:S%C3%A4uren_und_Laugen_-_Farbspektrum_verschiedener_Indikatoren.png;
- Bild pH-Meter: www.mbcoct.com/corning/images/90464.jpg;
Chemie heute - Sekundarbereich II, Schroedel Verlag, ISBN 3-507-10630-2, S. 118.
Autoren
--Lena
--Janina