Stöchiometrie: Lösungen: Unterschied zwischen den Versionen
Aus BS-Wiki: Wissen teilen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| Zeile 1: | Zeile 1: | ||
== Roheisenherstellung == | == Roheisenherstellung == | ||
a) Wieviel Eisenoxid muß eingesetzt werden, um 10 t reines Eisen zu gewinnen? | a) Wieviel Eisenoxid muß eingesetzt werden, um 10 t reines Eisen zu gewinnen? | ||
| − | #Reaktionsgleichung formulieren: 2 Fe<sub>2</sub>O<sub>3</sub> + 3 C [[Bild:Pfeil.gif]] 4 Fe + 3 CO<sub>2</sub> | + | #[[Reaktionsgleichung]] formulieren: 2 Fe<sub>2</sub>O<sub>3</sub> + 3 C [[Bild:Pfeil.gif]] 4 Fe + 3 CO<sub>2</sub> |
#[[Molare Masse]]n berechnen: M(Fe<sub>2</sub>O<sub>3</sub>) = 159,697 g/mol; M(Fe) = 55,85 g/mol | #[[Molare Masse]]n berechnen: M(Fe<sub>2</sub>O<sub>3</sub>) = 159,697 g/mol; M(Fe) = 55,85 g/mol | ||
#Verhältnis gemäß RG aufstellen: m(Fe<sub>2</sub>O<sub>3</sub>) = 2 · M(Fe<sub>2</sub>O<sub>3</sub>) · m(Fe) / 4 · M(Fe) | #Verhältnis gemäß RG aufstellen: m(Fe<sub>2</sub>O<sub>3</sub>) = 2 · M(Fe<sub>2</sub>O<sub>3</sub>) · m(Fe) / 4 · M(Fe) | ||
Version vom 17. Dezember 2007, 17:17 Uhr
Roheisenherstellung
a) Wieviel Eisenoxid muß eingesetzt werden, um 10 t reines Eisen zu gewinnen?
- Reaktionsgleichung formulieren: 2 Fe2O3 + 3 C
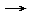 4 Fe + 3 CO2
4 Fe + 3 CO2 - Molare Massen berechnen: M(Fe2O3) = 159,697 g/mol; M(Fe) = 55,85 g/mol
- Verhältnis gemäß RG aufstellen: m(Fe2O3) = 2 · M(Fe2O3) · m(Fe) / 4 · M(Fe)
- Einsetzen: m(Fe2O3) = 159,697 g/mol · 10 t / 2 · 55,85 g/mol
- Ergebnis berechnen: m(Fe2O3) = 14,3 t bzw. 14.297 kg