Unter Aggregatzuständen versteht man die Zustandsformen der Materie, die sich in Abhängigkeit von Druck und Temperatur einstellen.
Vereinfachend lassen sich drei A. unterscheiden:
Im festen A. besitzt die Materie den höchsten Ordnungsgrad. Es überwiegen die anziehenden Kräfte zwischen den Atomen, wodurch diese an feste Plätze gebunden sind.
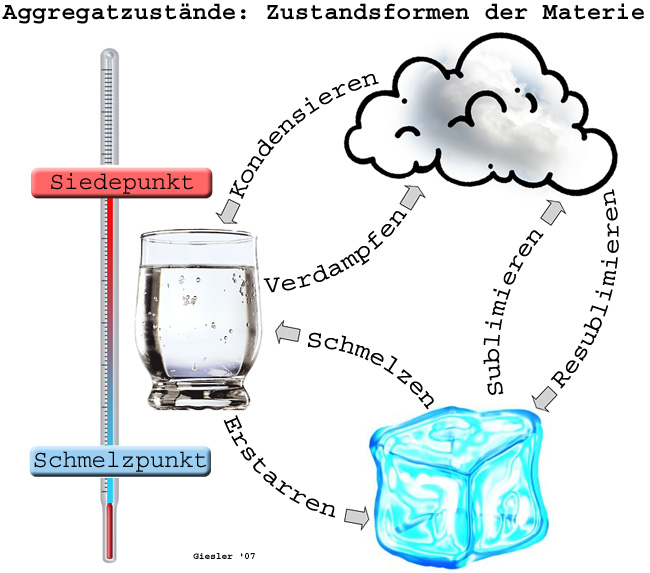
Durch Temp.-Erhöhung gelangt die Materie vom festen in den flüssigen A. (Schmelzen) u. weiter vom flüssigen in den gasf. A. (Verdampfen). Die Temp.-Werte, bei denen diese Übergänge bei Normalbedingungen stattfinden, werden als Schmelztemp. (Schmelzpunkt, Schmp.) bzw. Siedetemp. (Siedepunkt, Sdp.) bezeichnet. Beim entgegengesetzten Abkühlprozeß spricht man vom Erstarren (Erstarrungspunkt) bzw. Kondensieren (Kondensationspunkt).
Im gasförmigen A. liegt keine räumliche Ordnung mehr vor. Anziehende Kräfte zwischen den Teilchen sind, bei Abständen größer als einige nm, nicht mehr vorhanden. Die Eigenschaften der Substanz sind allein durch die Wärmebewegung gegeben. Gase füllen den ihnen zur Verfügung stehenden Raum gleichmäßig aus.
Unter bestimmten Bedingungen (Druck, Temperatur) geht Materie unter Umgehung des flüssigen Zustandes direkt vom festen in den gasförmigen Zustand über (Sublimieren). Dieses Verhalten lässt sich bei Normaldruck z. B. an Arsen, Iod oder Kohlendioxid (Trockeneis) beobachten.
Als vierter A. wird der Plasma-Zustand angesehen. Dieser Zustand wird erst bei sehr hohen Temperaturen, wie sie z. B. auf der Sonnenoberfläche herrschen, erreicht.
Experimente
- mehrstufige Destillation von Wein: Gleichgewicht zwischen einer Flüssigkeit und ihrem Dampf, in: Elemente Chemie 2, Seite 167, Versuch 1
- Mechanische Simulation der Aggregatzustände, in: Chemie? - Aber sicher!, Seite 04-3 mittels Magnetrührer
- Aggregatzustandsänderungen, in: Chemie? - Aber sicher!, Seite 05-3 mit Butan
- Aggregatzustände, in: Chemie? - Aber sicher!, Seite 05-5: Sublimation und Resublimation von Iod
- Iod sublimiert, in: Praktikum chemischer Demonstration, Versuch 4.2300
- Kristallisation