| Halbtitration | ||
|---|---|---|
| vernetzte Artikel | ||
| Säure-Base-Titration | Säurestärke | |
Zweck
Das Ziel einer Halbtitration ist die experimentelle Bestimmung der Säurestärke einer schwachen Säure.
Laborpraxis
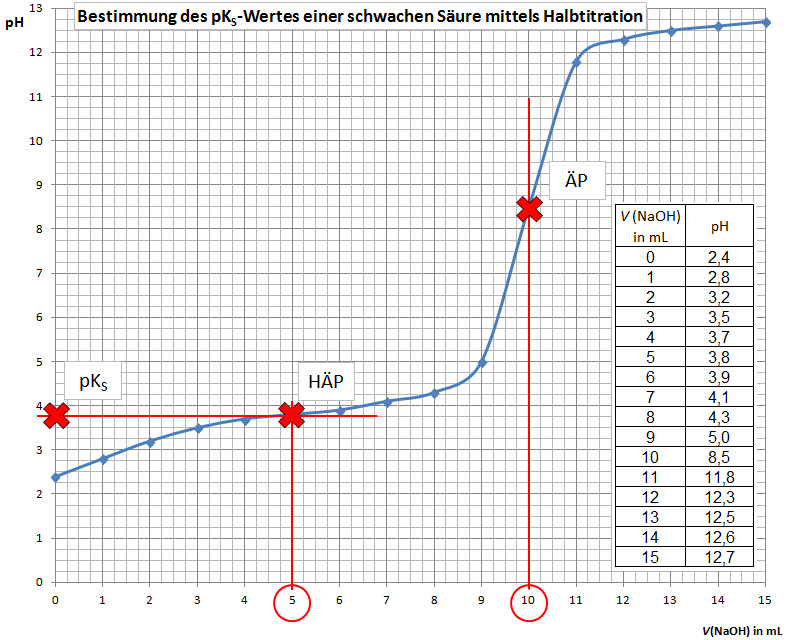
Hierbei wird die schwache Säure mit Natronlauge titriert. Aus der Messreihe (V(NaOH)/pH-Werte) wird eine Titrationskurve erstellt. Mit dieser Titrationskurve kann der pKS-Wert der schwachen Säure bestimmt werden:
- Lot fällen vom Äquivalenzpunkt (ÄP, Wendepunkt der Titrationskurve)
- V(NaOH) beim ÄP ablesen
- Halbäquivalenzpunkt (HÄP) einzeichnen: Senkrechte einzeichnen bei der Hälfte des NaOH-Verbrauches, der Schnittpunkt mit der Titrationskurve ist der Halbäquivalenzpunkt
- pKS-Wert ablesen: Der pKS-Wert entspricht dem pH-Wert am Halbäquivalenzpunkt.
Experimente
- Bestimmung des pKS-Wertes von Salicylsäure mittels Halbtitration, in: Elemente Chemie 2, Seite 219, Versuch 1
- Bestimmung des pKS-Wertes von Ameisensäure mittels Halbtitration gemäß Übungsaufgabe: 50 mL Ameisensäure in 5mL-Schritten mit NaOH bis ca. pH = 12 bzw. 80 mL NaOH titrieren.
Übungsaufgaben
- Elemente Chemie 2, Seite 219, Aufgabe 1: Bestimmung des pKS-Wertes von Ameisensäure mittels Halbtitration
Weblinks
- Halbtitration als Google-Suchbegriff
- Halbtitration in der Wikipedia
- Halbtitration hier in bs-wiki.de mit Google
- Halbtitration als Youtube-Video
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Halbtitration: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
- Titrationskurve von Ameisensäure als Excel-Tabellenblatt