Elemente streben über eine chemische Reaktion einen energiearmen Zustand der Außenelektronen an, die Edelgaskonfiguration. Diese vollständige Besetzung der Außenschale erreichen sie durch Übertragung von Elektronen gemäß ihrer Wertigkeit.
Die Wertigkeit ist die Anzahl der Elektronen, die ein Atom aufnimmt bzw. abgibt, um eine vollbesetzte Außenschale zu erlangen.
Im einfachsten Fall leitet sich die W. eines Elementes daher aus der Nummer der Hauptgruppe und damit aus der Anzahl der Außenelektronen ab:
| Hauptgruppe | 1. (I A) | 2. (II A) | 3. (III A) | 4. (IV A) | 5. (V A) | 6. (VI A) | 7. (VII A) | 8. (VIII A) |
|---|---|---|---|---|---|---|---|---|
| Außenelektronen | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Wertigkeit | 1 | 2 | 3 | 4 | 3 | 2 | 1 | 0 |
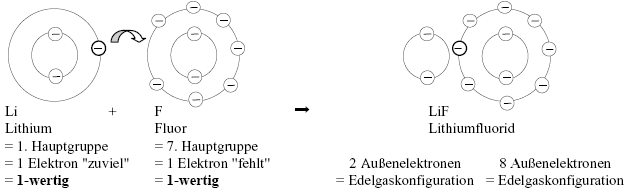
Beispiel:
Bei identischen Wertigkeiten ist die Rohformel (LiF) also gleichzeitig die Summenformel.
Unterscheiden sich die Wertigkeiten der Reaktionspartner, erhält man die Indices der Summenformel durch Vertauschen der Wertigkeiten, z. B. reagiert das 3-wertige Aluminium mit dem 2-wertigen Schwefel zu Al2S3.