Elektrolyse von Wasser: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) (→Übung) |
Dg (Diskussion | Beiträge) (→Übung) |
||
| Zeile 43: | Zeile 43: | ||
== Übung == | == Übung == | ||
| − | Durch [[Elektrolyse|{{x}}]] im [[Wasserzersetzungsapparat| | + | Durch [[Elektrolyse|{{x}}]] im [[Wasserzersetzungsapparat|{{x}}]] lässt sich Wasser in seine Bestandteile [[Wasserstoff|{{x}}]] und [[Sauerstoff|{{x}}]] aufspalten. Zur Erhöhung der [[elektrischen Leitfähigkeit|{{x}}]] muss ein Elektrolyt im Wasser gelöst werden, z. B. [[Natriumhydroxid|{{x}}]]. Nach dem Anlegen einer [[Gleichspannung|{{x}}]] werden am [[Minuspol|{{x}}]] zwei Volumenteile [[Wasserstoff|{{x}}]] und am [[Pluspol|{{x}}]] ein Volumenteil [[Sauerstoff|{{x}}]] abgeschieden. Das gebildete Volumenverhältnis steht im Einklang mit der [[Summenformel|{{x}}]](H<sub>2</sub>O). Beide Gase können durch entsprechende Reaktionen nachgewiesen werden: [[Sauerstoff|{{x}}]] durch die [[Glimmspanprobe|{{x}}]] und [[Wasserstoff|{{x}}]] durch die [[Knallgasprobe|{{x}}]]. |
| − | Die Umkehrung der Elektrolyse von Wasser ist das Arbeitsprinzip der [[Brennstoffzelle| | + | Die Umkehrung der Elektrolyse von Wasser ist das Arbeitsprinzip der [[Brennstoffzelle|{{x}}]]. |
Betrachtung auf Teilchenebene: | Betrachtung auf Teilchenebene: | ||
| − | * Unter der Annahme einer vollständigen Elektronenübertragung wäre folgende Ionenbildung aus Wasser denkbar: H<sub>2</sub>O[[Bild:Pfeil.gif]]O<sup>[[2-| | + | * Unter der Annahme einer vollständigen Elektronenübertragung wäre folgende Ionenbildung aus Wasser denkbar: H<sub>2</sub>O[[Bild:Pfeil.gif]]O<sup>[[2-|{{x}}]]</sup> + [[2H|{{x}}]]<sup>+</sup> |
| − | * Nach Anlegen der Spannung herrscht am Minus-Pol ein [[Elektronenüberschuss, Elektronendruck| | + | * Nach Anlegen der Spannung herrscht am Minus-Pol ein [[Elektronenüberschuss, Elektronendruck|{{x}}]], dadurch wird das [[H|{{x}}]]<sup>+</sup>-Ion angezogen. Durch [[Elektronenaufnahme|{{x}}]] wird das Ion reduziert, es entsteht elementarer [[Wasserstoff|{{x}}]]. |
| − | * Am Plus-Pol herrscht [[Elektronenmangel, Elektronensog| | + | * Am Plus-Pol herrscht [[Elektronenmangel, Elektronensog|{{x}}]], dadurch wird das [[O|{{x}}]]<sup>2-</sup>-Ion angezogen. Durch [[Elektronenabgabe|{{x}}]] wird das Ion oxidiert, es entsteht elementarer [[Sauerstoff|{{x}}]]. |
| − | * Da Oxidation und [[Reduktion| | + | * Da Oxidation und [[Reduktion|{{x}}]] zwar räumlich voneinander getrennt, jedoch [[zeitgleich|{{x}}]] stattfinden, spricht man auch von einer [[Redoxreaktion|{{x}}]]. |
=== Zum Vergleich === | === Zum Vergleich === | ||
Version vom 23. März 2010, 01:52 Uhr
| Elektrolyse von Wasser | ||
|---|---|---|
| vernetzte Artikel | ||
| Elektrolyse | Wasserzersetzungsapparat | |
Bei dieser Elektrolyse wird Wasser (H2O) in die Elemente Sauerstoff und Wasserstoff zerlegt, z. B. im Wasserzersetzungsapparat. Beide Gase können über charakteristische Reaktionen nachgewiesen werden.
Die Umkehrung der Elektrolyse von Wasser ist das Arbeitsprinzip der Brennstoffzelle.
Inhaltsverzeichnis
Experiment
Wie funktioniert die Elektrolyse von Wasser?
Geräte
Wasserzersetzungsapparat mit Deckel, 2 Messzylinder (10 mL), Netzgerät, 2 Stromkabel, Pinzette, Schutzbrille, Stopp-Uhr
Chemikalien
Ca. 100 mL heißes Leitungswasser, ca. 0,2 g Natriumhydroxid (1 NaOH-Plätzchen) zur Erhöhung der elektrischen Leitfähigkeit
- UVV: Gefahr der Verätzung bei direktem Kontakt mit NaOH. Das NaOH-Plätzchen nur mit Pinzette anfassen und Schutzbrille aufsetzen.
- Entsorgung: Ausguss
Durchführung
Behälter im Wasserzersetzungsapparat ohne Messzylinder etwa halbvoll mit dem Wasser befüllen. Die Messzylinder werden ebenfalls mit Wasser gefüllt, mit einem Finger zugehalten, in den Behälter eingetaucht und senkrecht über die Platinelektroden gestellt. Bei richtiger Handhabung bleiben beide Zylinder voll befüllt! Das NaOH-Plätzchen ins Wasser geben und den Deckel aufsetzen.
Über die Anschlussbuchsen wird das Gerät an die Gleichstromquelle (25 V) angeschlossen und die Stopp-Uhr gestartet.
Beobachtungsauftrag
Protokolliere im Minutentakt das am Plus- und Minuspol gebildete Gasvolumen und stelle Deine Messwerte tabellarisch zusammen. Schalte den Strom aus, wenn in einem Messzylinder alles Wasser durch Gas verdrängt wurde.
Auswertung
Erkläre die Vorgänge an den Elektroden und die jeweils gebildeten Gasmengen.
Detailfragen:
- Wie ist die Ladungsverteilung im H2O-Molekül?
- In welche Ionen könnte des H2O-Molekül zerfallen, wenn die Elektronen vollständig auf das stärker Elektronen anziehende Element übertragen würden?
- Was geschieht mit den Ionen nach dem Anlegen der Gleichspannung?
- Beschreibe die Elektronenübertragungsvorgänge am jeweiligen Pol und fasse Deine Aussagen zu Reaktionsgleichungen zusammen.
- Welches Gas wird am Minuspol gebildet, welches am Pluspol?
- Wo findet eine Oxidation bzw. Reduktion statt?
- Wie lässt sich das Verhältnis der Gasmengen erklären?
- Wie lässt sich beweisen, welches Gas sich an welchem Pol gebildet hat?
Übung
Durch _____________________ im _____________________ lässt sich Wasser in seine Bestandteile _____________________ und _____________________ aufspalten. Zur Erhöhung der _____________________ muss ein Elektrolyt im Wasser gelöst werden, z. B. _____________________ . Nach dem Anlegen einer _____________________ werden am _____________________ zwei Volumenteile _____________________ und am _____________________ ein Volumenteil _____________________ abgeschieden. Das gebildete Volumenverhältnis steht im Einklang mit der _____________________ (H2O). Beide Gase können durch entsprechende Reaktionen nachgewiesen werden: _____________________ durch die _____________________ und _____________________ durch die _____________________ .
Die Umkehrung der Elektrolyse von Wasser ist das Arbeitsprinzip der _____________________ .
Betrachtung auf Teilchenebene:
- Unter der Annahme einer vollständigen Elektronenübertragung wäre folgende Ionenbildung aus Wasser denkbar: H2O
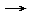 O _____________________ + _____________________ +
O _____________________ + _____________________ + - Nach Anlegen der Spannung herrscht am Minus-Pol ein _____________________ , dadurch wird das _____________________ +-Ion angezogen. Durch _____________________ wird das Ion reduziert, es entsteht elementarer _____________________ .
- Am Plus-Pol herrscht _____________________ , dadurch wird das _____________________ 2--Ion angezogen. Durch _____________________ wird das Ion oxidiert, es entsteht elementarer _____________________ .
- Da Oxidation und _____________________ zwar räumlich voneinander getrennt, jedoch _____________________ stattfinden, spricht man auch von einer _____________________ .

