Verbrennung: Unterschied zwischen den Versionen
(→Worin liegt der Unterschied zwischen dem vollkommenen und dem unvollkommenen Brennen?) |
(→Worin liegt der Unterschied zwischen dem vollkommenen und dem unvollkommenen Brennen?) |
||
| Zeile 230: | Zeile 230: | ||
=== Unvollkommenes Brennen === | === Unvollkommenes Brennen === | ||
| − | [[Bild:Flashover.jpg|thumb|Flash Over| | + | [[Bild:Flashover.jpg|thumb|Flash Over|right]] |
Bei dem unvollkommenen Brennen ist nur wenig Sauerstoff während des Brennvorgangs vorhanden. Das hat zur Folge, dass sich als neues Produkt Kohlenmonoxid (chemische Formel CO) bildet. | Bei dem unvollkommenen Brennen ist nur wenig Sauerstoff während des Brennvorgangs vorhanden. Das hat zur Folge, dass sich als neues Produkt Kohlenmonoxid (chemische Formel CO) bildet. | ||
Version vom 9. März 2007, 22:37 Uhr
von Sebastian B.
Eine Verbrennung ist eine Redoxreaktion unter Abgabe von Wärme, insbesondere auch von Licht und flüchtigen Stoffen.
Im allgemeinen Sprachgebrauch versteht man unter einer Verbrennung die Redoxreaktion eines Materials mit Sauerstoff. Zu unterscheiden ist eine Verbrennung in Form eines Feuers mit Flammenerscheinung von einer unvollständigen Verbrennung (Schwelbrand, Verkokeln), sowie langsamen und relativ kalten Oxidation, etwa beim Verrosten von Metallen.
- Feuer Kaserne.JPG
Abgebranntes Gebäude
Inhaltsverzeichnis
- 1 Oxidation und Brennen – was ist das eigentlich?
- 2 Welche Lichterscheinungen gibt es beim Brennen?
- 3 Brennbare Stoffe
- 4 Was ist der Unterschied zwischen Dämpfen und Gasen?
- 5 Die Flamme
- 6 Die Glut
- 7 Welche Bedingungen müssen erfüllt sein, damit eine Verbrennung stattfinden kann?
- 8 Was verstehen wir unter „Brennbarkeit“ eines Stoffes?
- 9 Was verstehen wir unter „Entzündbarkeit“ eines Stoffes?
- 10 Worin liegt der Unterschied zwischen dem vollkommenen und dem unvollkommenen Brennen?
- 11 Wie wirken sich besonders schnell verlaufende Brennvorgänge aus?
- 12 Was ist Sauerstoff?
Oxidation und Brennen – was ist das eigentlich?
Sicherlich hast Du schon einmal ein Stück blanken und ein Stück rostigen Stahl gesehen. Was hat eigentlich das eine Stück Stahl rostig gemacht? Der blanke Stahl hat sich mit Sauerstoff verbunden und dabei entstand ein völlig neues Produkt, nämlich Rost.
Nun verbindet sich Sauerstoff nicht nur mit Stahl, sondern auch mit einer großen Menge anderer Stoffe. Bei allen diesen Verbindungen entsteht jedes Mal ein neues Produkt.
Ein weiteres Beispiel:
Wasserstoff + Sauerstoff ![]() Wasser
Wasser
Der lateinische Name für Sauerstoff ist Oxygenium. Wir können sagen:
Wenn sich irgendein Stoff mit Sauerstoff verbindet, dann nennen wir diesen Verbindungsvorgang Oxidation oder auch: ein Stoff wird oxidiert.
Das Produkt, was bei diesem Vorgang entsteht, nennen wir Oxid. Wenn wir bei unseren bisherigen Beispielen bleiben, können wir sagen: Rost und Wasser sind Oxide, die bei einer Oxidation entstanden sind. Die Oxidation ist ein chemischer Vorgang und kann mit verschiedenen Geschwindigkeiten ablaufen.
z.B. sehr langsam – über Jahre und Jahrzehnte
- Holz wird tot
- Gummi wird hart und rissig
langsam – über Monate, Tage, Stunden
- Stahl rostet
- Mist gärt
Bei Oxidationsvorgängen wird Wärme frei. Verständlicherweise lässt sie sich bei sehr langsamen und langsamen Oxidationen nicht nachweisen – aber bei schnell verlaufenden Oxidationen. Es gibt schnell verlaufende Oxidationsvorgänge, bei denen während der Verbindung so viel Wärme frei wird, dass dabei eine Lichterscheinung zu sehen ist. In diesem Fall haben wir es mit einem besonderen Oxidationsvorgang zu tun, den wir Brennen nennen. Die Lichterscheinung ist ein physikalischer Vorgang.
Deshalb können wir sagen:
Wenn sich ein Stoff mit Sauerstoff unter Lichterscheinung verbindet, dann haben wir es mit einer speziellen Oxidation zu tun. Diese Oxidation nennen wir Brennen. Stoffe, die sich unter Lichterscheinung mit Sauerstoff verbinden (jetzt können wir auch sagen: brennen), nennen wir brennbare Stoffe.
Welche Lichterscheinungen gibt es beim Brennen?
Wir kennen zwei Arten von Lichterscheinungen:
a) Flammen
b) Glut
Bei vielen Brennvorgängen treten beide Lichterscheinungen gleichzeitig auf. Somit gibt es eigentlich noch eine dritte:
c) Flammen und Glut zusammen
Brennbare Stoffe
Gasförmige brennbare Stoffe
Nur mit Flammen.
Flüssige brennbare Stoffe
Nur mit Flammen, weil sie vor dem Brennen in Dampf-Form übergehen. Der Temperaturpunkt, bei dem gerade ausreichende Dämpfe zur kurzen Entflammung gebildet werden, nennen wir Flammpunkt (nur bei brennbaren Flüssigkeiten).
Befindet sich eine brennbare Flüssigkeit unter dem Flammpunkt, so ist kein Brennen möglich.
Weil beim Erreichen des Flammpunktes das "erste Aufflammen" einer brennbaren Flüssigkeit möglich ist, bedient sich auch die "Verordnung über Anlagen zur Lagerung, Abfüllung und Beförderung brennbarer Flüssigkeiten zu Lande" (VbF) des Flammpunkts als Merkmal für die Gefahr. Er gibt nämlich Auskunft, ob wir es mit einem mehr oder weniger gefährlichen Produkt zu tun haben.
Die VbF teilt die brennbaren Flüssigkeiten in Gefahrklassen ein, und zwar:
A (mit Wasser NICHT mischbar)
Die brennbaren Flüssigkeiten der Gefahrklasse A werden entsprechend ihrem Flammpunkt zusätzlich unterteilt in:
A I - Flammpunkt unter 21°C
A II - Flammpunkt zwischen 21°C und 55°C
A III - Flammpunkt zwischen 55°C und 100°C
und B (mit Wasser MISCHBAR)
Flammpunkt unter 21°C
Flüssigkeiten oder deren brennbaren flüssige Bestandteile, die sich bei 15°C in Wasser in beliebigem Verhältnis lösen
Feste brennbare Stoffe
- mit Flammen und Glut, weil durch die Zersetzung der brennbaren Stoffe gasförmige und feste Teile entstehen, z.B. bei Holz, Kohle, Papier
- nur mit Flammen, weil sie nach Verflüssigung brennbare Dämpfe entwickeln, z.B. bei Wachs, Stearin, Fett
nur mit Glut, Metalle und künstlich entgaste Stoffe, z.B. bei Magnesium, Koks, Holzkohle
Was ist der Unterschied zwischen Dämpfen und Gasen?
Dämpfe - Stoffe deren Siedepunkt bei normalem Luftdruck ÜBER Zimmertemperatur (20°C) liegt.
Gase - Stoffe, deren Siedepunkt bei normalem Luftdruck UNTER Zimmertemperatur (20°C) liegt.
Die Flamme
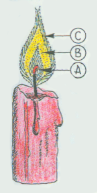
Die Flamme ist der Bereich brennender Gase oder Dämpfe, von dem sichtbare Strahlung ausgeht. Ein gutes Beispiel ist die Kerze.
Außer der Schmelzzone sind noch folgende Zonen zu nennen:
A = Dampfzone; Verdampfung der flüssig gewordenen brennbaren Stoffe
B = Glühzone; Teilung der Brennstoffdämpfe in die Grundbestandteile Kohlenstoff und Wasserstoff
C = Brennzone; Nur hier, wo der Luftsauerstoff zutreten kann, findet das Brennen und die Wärmeentwicklung statt.
Die Glut
Die Glut ist ein erwärmter fester oder flüssiger (z.B. geschmolzenes Metall) Stoff mit sichtbarer Wärmestrahlung. Aus der Glutfarbe können Rückschlüsse auf die Brandtemperatur gezogen werden:
400°C = Grauglut (nur im Dunkeln wahrnehmbar)
525°C = Dunkelrotglut
700°C = dunkle Rotglut
900°C = helle Rotglut
1100°C = Gelbglut
1300°C = beginnende Weißglut
1500°C = voll blendende Weißglut
Welche Bedingungen müssen erfüllt sein, damit eine Verbrennung stattfinden kann?
Sicherlich hast Du schon einmal zugesehen, wie Papier verbrennt. Wenn alles verbrannt ist, hört es auf zu brennen. Eigentlich banal, aber hierdurch haben wir bereits die erste Vorbedingung des Brennens kennengelernt.
1. Brennbarer Stoff muss vorhanden sein
Wer kennt nicht den Versuch, bei dem ein Glaszylinder über eine brennbare Kerze gestülpt wird? Nach kurzer Zeit erlischt die Kerze. Warum? Der Glaszylinder verhindert den Zutritt des Sauerstoffs der Luft. Damit sind wir bei der zweiten Vorbedingung des Brennens.
2. Sauerstoff muss vorhanden sein
Versuche einmal, ein Häufchen Mehl auf einem Blechdeckel anzuzünden. Anschließend blase mal einen Löffel davon in eine Gasflamme. Während im ersten Fall nur ein leichtes Glimmen wahrnehmbar ist, brennt das Mehl im zweiten Fall sehr heftig. Hieraus können wir die dritte Vorbedingung des Brennens ableiten.
3. Sauerstoff und brennbarer Stoff müssen im richtigen Mengenverhältnis zueinander stehen
Täglich entzünden wir Zigaretten, Papier oder Gasflammen mit Streichhölzern oder Feuerzeugen. Was tun wir dann eigentlich? Wir erwärmen den brennbaren Stoff, oder besser: wir erfüllen die vierte Vorbedingung des Brennens.
4. Der brennbare Stoff muss auf seine Zündtemperatur erwärmt werden
Wirksame Zündquellen, die einen brennbaren Stoff auf seine Zündtemperatur erwärmen, können beispielweise sein:
- heiße Oberflächen
- Feuer, Flamme, Glut
- mechanisch erzeugte Funken (Winkelschleifer, Bandschleifer, etc.)
- elektrisch erzeugte Funken (Kurzschluss, Schalter, etc.)
- elektrostatische Entladungsfunken (Laufbänder, Teppichboden, etc.)
Erst wenn alle vier Bedingungen zur selben Zeit erfüllt sind, kommt es zum Brennen.
Was verstehen wir unter „Brennbarkeit“ eines Stoffes?
Nicht alle brennbaren Stoffe verhalten sich während des Brennvorgangs gleich. Deshalb unterteilen wir die brennbaren Stoffe nach ihrer Brennbarkeit.
A - Schwer brennbare Stoffe
Sie brennen nach dem Entzünden nur bei Zufuhr von Fremdwärme weiter und erlöschen daher nach Fortnahme der Zündquelle wieder. Ein natürlicher Stoff, der diese schwer brennbare Eigenschaft hat, ist Schafwolle. Mit chemischen Mitteln kann man auch andere Stoffe schwer brennbar machen (z.B. Luftschlangen für Faschingsveranstaltungen).
B - Normal brennbare Stoffe
Sie brennen nach dem Entzünden und Fortnahme der Zündquelle von selbst mit normaler Geschwindigkeit weiter. Holz und Papier beispielweise gehören zu den normal brennbaren Stoffen.
C - leicht brennbare Stoffe
Sie brennen nach dem Entzünden und Fortnahme der Zündquelle von selbst mit hoher Geschwindigkeit weiter. Zum Beispiel Zellhorn (Film und Tischtennisball), Gase und Stroh gehören zu dieser Art Stoffe.
Was verstehen wir unter „Entzündbarkeit“ eines Stoffes?
Bevor ein Stoff brennt, muß er erst einmal entzündet werden (= der Brennstoff muß auf seine Zündtemperatur erwärmt werden). Auch hier verhalten sich nicht alle Brennstoffe gleich. Deshalb unterscheiden wir sie nach ihrer Entzündbarkeit.
Selbstentzündbare Stoffe
Dazu gehören alle brennbaren Stoffe, die ohne äußere Energiezufuhr zur Entzündung kommen.
z.B.: weißer Phosphor oder Natriummetall in Wasser
Leicht entzündbare Stoffe
Dazu gehören alle brennbaren Stoffe, die mit der Zündenergie einer Zigarette zur Entzündung gebracht werden können (ca. 600°C).
z.B.: Zellhorn (Während sich Zeitungspapier unter normalen Umständen nicht mit einer Zigarette anzünden läßt, flammt Zellhorn schon nach kurzer Zeit auf)
Normal entzündbare Stoffe
Dazu gehören alle brennbaren Stoffe, die mit der Zündenergie eines Streichholzes zur Entzündung gebracht werden können (ca. 800°C).
z.B.: Holzspäne oder Papier
Schwer entzündbare Stoffe
Dazu gehören alle brennbaren Stoffe, die mit der Zündenergie einer Lötlampe zur Entzündung gebracht werden können (ca. 1500°C).
z.B.: Holzkohle, Koks oder große Holzstücke
Worin liegt der Unterschied zwischen dem vollkommenen und dem unvollkommenen Brennen?
Unvollkommenes Brennen
Bei dem unvollkommenen Brennen ist nur wenig Sauerstoff während des Brennvorgangs vorhanden. Das hat zur Folge, dass sich als neues Produkt Kohlenmonoxid (chemische Formel CO) bildet.
Kohlenmonoxid ist brennbar (bildet es sich z.B. bei einem Kellerbrand, so kann es durch das öffnen der Tür (= Zutritt von Sauerstoff) zu einer Verpuffung (auch als >>flash over<< oder >>Backdraft<< bezeichnet) kommen. Desweiteren ist Kohlenmonoxid giftig (gefährliches Atemgift) und leichter als Luft (also unter der Decke, das ist ein Grund, weshalb man mit der Nase möglichst weit am Fußboden sein sollte).
Vollkommenes Brennen
Bei dem vollkommenen Brennen ist genügend Sauerstoff während des Brennvorgangs vorhanden. Als Endprodukt entsteht hierbei Kohlendioxid (chemische Formel CO2, handelsübliche Bezeichnung: Kohlensäure).
Kohlendioxid ist:
- nicht brennbar (deshalb wird es auch als Löschmittel verwendet)
- schwerer als Luft
- in normaler Konzentration nicht giftig (wenn die Konzentration jedoch höher als 5% ist, wird Kohlendioxid zu einem gefährlichen Atemgift)
Wie wirken sich besonders schnell verlaufende Brennvorgänge aus?
An anderer Stelle wurde schon erwähnt, dass jeder Brennvorgang ein schnell verlaufender Oxidationsvorgang ist. Aber auch die Brennvorgänge werden nochmals nach ihrer Abbrandrate (=Abbrandgeschwindigkeit) unterschieden, und zwar:
Detonation
Eine Detonation ist eine durch eine Stoßwelle ausgelöste Flammenreaktion, die sich mit Geschwindigkeiten bis zu einigen km/sec fortpflanzt.
Explosion
Eine Explosion ist eine wärmefreisetzende Reaktion in explosionsfähigen Gemischen, die noch nicht zur Detonation führt.
Geschwindigkeit wird in m/sec gemessen.
Verpuffung
Eine Verpuffung ist eine Explosion mit geringer Druckwirkung.
Geschwindigkeit wird in cm/sec gemessen.
Ein Brennvorgang verläuft umso schneller, je günstiger (intensiver) das Mengenverhältnis zwischen brennbarem Stoff und Sauerstoff ist.
Was ist Sauerstoff?
In jeder Drogerie ist Kaliumpermanganat (ein starker Sauerstoffträger) zu kaufen. Wenn wir es erhitzen und einen in normaler Luft leicht glühenden Holzspan hineinhalten, beginnt dieser Lichterloh zu brennen. Was ist geschehen? Durch die Erwärmung des Kaliumpermanganats wird reiner Sauerstoff frei, der den Brennvorgang stark fördert. Der Sauerstoff hat folgende Eigenschaften:
- er ist zu 21% in der Luft enthalten
- er brennt selbst nicht, aber er fördert das Brennen (bzw. er macht es erst möglich)
- ist die Konzentration kleiner als 17%, dann ist in den meisten Fällen kein Brennen mehr möglich
(Der Mensch wird bewusstlos bei einer Sauerstoffkonzentratin von unter 15-17% und stirbt bei einer Sauerstoffkonzentrazin von unter 15%, in sehr hoher Konzentration wirkt Sauerstoff beruhigend auf den Menschlichen Körper.)
- er ist farb-, geruch- und geschmacklos (also mit unseren Sinnen nicht wahrnehmbar)
Siehe auch: